Abstract
Zgodnie ze stanowiskiem grupy ekspertów Sekcji Elektrokardiologii Nieinwazyjnej i Telemedycyny Polskiego Towarzystwa Kardiologicznego podstawowa zasada opisu elektrokardiogramu (EKG) obejmuje dziesięć punktów. Dlatego jest ona nazywana dekalogiem opisu. Dla lepszej przejrzystości można uprościć zasady podstawowego opisu EKG do siedmiu kroków. Tak stworzony heptalog obejmuje ocenę rytmu wiodącego serca, zaburzeń przewodzenia nadkomorowych i komorowych, powiększeń jam serca, zmian niedokrwiennych, występowania arytmii i nieprawidłowości związanych ze stymulacją/defibrylacją serca.
Publikacja jest tłumaczeniem artykułu Kozłowski D. Method in the Chaos – a step-by-step approach to ECG interpretation. Eur J Transl Clin Med 2018;1(1):74-90.
DOI: 10.31373/ejtcm/92255
Citation
Kozłowski D. Jak uporządkować chaos, czyli interpretacja EKG krok po kroku. Eur J Transl Clin Med. 2019;2(2):05-39Zgodnie ze stanowiskiem grupy ekspertów Sekcji Elektrokardiologii Nieinwazyjnej i Telemedycyny Polskiego Towarzystwa Kardiologicznego podstawowa zasada opisu elektrokardiogramu (EKG) obejmuje dziesięć punktów. Dlatego jest ona nazywana dekalogiem opisu. Dla lepszej przejrzystości można uprościć zasady podstawowego opisu EKG do siedmiu kroków (ryc. 1).

Ryc. 1. Siedm kroków czyli heptalog oceny zapisu EKG
Opis elektrokardiogramu należy rozpocząć od określenia podstawowego rytmu lub rytmów serca widocznych w EKG (krok 1). Opisujący musi ocenić rytm wiodący, jego pochodzenie (zatokowe, przedsionkowe, komorowe, z układu bodźcotwórczego czy stymulatora) oraz jego częstotliwość. W następnym punkcie (krok 2) należy przeanalizować oś elektryczną serca. Oznaczenie osi elektrycznej jest bardzo ważne ze względu na potencjalnie występujące patologie. Patologiczna oś elektryczna powinna automatycznie skierować naszą uwagę na nieprawidłowości elektrokardiogramu. Oś elektryczną opisuje się zawsze, powinna więc stanowić stały punkt opisu.
Następnym krokiem (krok 3) jest analiza wszystkich zaburzeń przewodzenia w sercu, najczęściej związanych z bradyarytmią. Jest to bardzo ważny punkt, bez którego nie można oceniać innych patologii w EKG (przerostów komór serca, ostrych zespołów wieńcowych). Analizy zaburzeń przewodzenia najlepiej dokonywać step-by-step, rozpoczynając od najwyższego piętra – czyli zatokowo-przedsionkowego, dalej przedsionkowo-komorowego, aż w końcu śródkomorowego.
W następnym kroku (krok 4) należy ocenić jamy serca w aspekcie ich powiększenia i/lub przerostów. Kolejny krok (krok 5) analizuje wszystko, co wiąże się z chorobą niedokrwienną serca, zawałem serca i przebytymi incydentami wieńcowymi. W tym kroku opisuje się morfologię zespołów komorowych pod kątem występowania patologicznych załamków Q, zespołów QS czy zmian załamków R, a także zmian zespołu ST-T. Krok 6 różnicuje różnego rodzaju tachyarytmie. Ostatni krok (krok 7) ma za zadanie opisać funkcjonowanie stymulatora lub defibrylatora pod względem skuteczności działania oraz ewentualnych zaburzeń sterowania (ryc. 1).
Krok 1 – Ocena rytmu wiodącego
Podstawę w diagnostyce różnicowej różnych schorzeń miokardium w oparciu o elektrokardiogram stanowi ocena pierwszego kroku, czyli rytmu serca. Celem właściwej jego oceny należy wykonać trzy małe kroki.
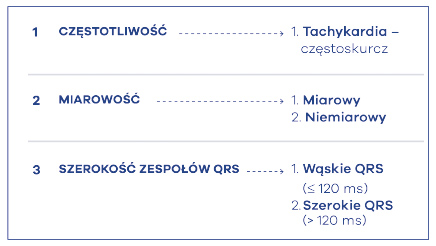
Najpierw trzeba stwierdzić, czy rytm zawiera się w prawidłowych przedziałach częstotliwości. Prawidłowa częstotliwość rytmu serca to 60-100 uderzeń na minutę i określa się ją mianem normokardii. Zwolniona akcja serca to rzadkoskurcz, czyli bradykardia, której częstotliwość wynosi poniżej 60 ud./min. Natomiast częstoskurcz określamy mianem tachykardii jako rytm serca powyżej 100 ud./min (ryc. 2).

Ryc. 2. Ocena rytmu serca w przedsionkach
Prostym sposobem przybliżonej oceny częstotliwości przy przesuwie papieru 25 mm/s jest tzw. „zasada trzystu”. Polega ona na tym, że dzielimy 300 przez liczbę dużych (5-milimetrowych, ograniczonych grubymi kreskami) kratek. Tak więc, jeśli odstęp RR wynosi np. 400 ms (0,4 s) i równa się dwóm dużym kratkom, to jego częstotliwoś według powyższej zasady wynosi 300 podzielone na dwa, czyli 150/min. Interpretując zapis wykonany przy przesuwie 50 mm/s wystarczy podwoić wyżej opisane parametry, co daje tzw. „regułę sześciuset”.
Następnym posunięciem jest ocena miarowości rytmu. Bardzo ważne jest przy tym rozróżnienie miarowości miarowej od niemiarowej a także niemiarowości miarowej od niemiarowej. Odróżnienie poszczególnych typów miarowości nie jest jednak proste. W obrębie miarowości możemy wyróżnić miarowość, zupełną i niezupełną. O miarowości całkowitej, czyli zupełnej, mówimy, kiedy w ocenie elektrokardiograficznej przy użyciu kroczka zachowane są całkowicie miarowe odstępy pomiędzy załamkami P przedsionkowymi i zespołami QRS komorowymi. Jeśli miarowe odstępy pomiędzy wymienionymi załamkami P i zespołami QRS nie są zupełnie miarowe, ale spełniają kryteria różnicy pomiędzy poszczególnymi zespołami mniejszej niż 1) 10% poprzedzających odstępów lub 2) mniejszej niż 160 ms poprzedzających odstępów, to miarowość taką określamy jako niezupełną (ryc. 3). Jeśli chodzi o niemiarowość to jej ocena jest znacznie prostsza. Oceniając rytm jako niemiarowy należy stwierdzić, czy jest on całkowicie chaotyczny, bezładny czy bardziej uporządkowany (ryc. 4). Nie ma standardu dokładnej oceny jak te dwie niemiarowości różnicować, dość powiedzieć, że miarowość chaotyczna nie daje się sklasyfikować w żadne schematy, dlatego – zgodnie z teorią chaosu – jest niemiarowością, której nie można uporządkować. I takim przykładem jest oczywiście migotanie przedsionków. Natomiast niemiarowość miarową najlepiej prezentują częstoskurcze przedsionkowe bądź trzepotanie przedsionków ze zmiennym, czynnościowym blokiem p-k, co daje niemiarowość uporządkowaną.

Ryc. 3. Ocena poszczególnych typów miarowości
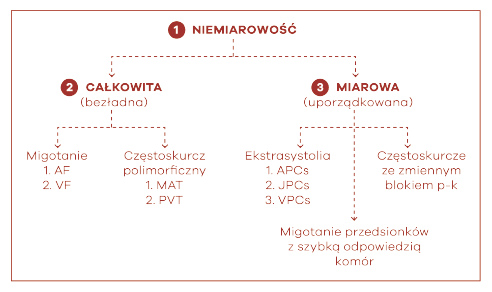
Ryc. 4. Ocena poszczególnych typów niemiarowości
Kolejnym punktem oceny rytmu, uwzględniającym poprzednie dwa kroki, jest ocena jego pochodzenia – czy ma on cechy rytmu zatokowego vs. pozazatokowego (przedsionkowego czy węzłowego) (ryc. 5 i 6). Analiza pobudzenia szerzącego się w przedsionkach, a zarazem ustalająca pochodzenie rytmu, powinna skupić się na morfologii podstawowej fali depolaryzacji przedsionków – czyli załamka P/P’. Jeśli dany rytm jest pochodzenia zatokowego, pobudzenie powinno rozchodzić się w przedsionkach z góry na dół i równocześnie z prawej strony na lewą. Najlepszym odprowadzeniem do oceny PP→LP jest odprowadzenie I. Jeśli w odprowadzeniu I załamek P jest dodatni (+) to aktywacja przesuwa się z PP→LP. Jeśli odwrotnie i załamek P jest ujemny (-) to idzie z LP→PP. Tak więc przy rozpoznaniu rytmu zatokowego w odprowadzeniu I wychylenie powinno być dodatnie (PI +) (ryc. 5). Do dokładnej analizy drogi impulsu w płaszczyźnie czołowej służą elektrody położone na dole, tzn. przyczepione do kończyny dolnej: II, III, aVF. Najlepiej odwzorowują one impuls w kierunkach góra-dół. Tak więc dla rytmu zatokowego muszą one „zobaczyć” zbliżający się impuls, bo idzie on z góry przedsionka. Wtedy załamki P w tych odprowadzeniach powinny być dodatnie (+). Dodatkowo do oceny takiego rozchodzenia się impulsu można wybrać dwie położone przeciwlegle elektrody aVR – right na poziomie przedsionka prawego, a po przeciwnej stronie elektrodę aVL – left. Prawidłowy front aktywacji przedsionków, tj. pochodzący z węzła zatokowo-przedsionkowego, musi oddalać się od elektrody aVR, a przybliżać się do elektrody aVL. Tak więc dla rytmu zatokowego załamek P w tych odprowadzeniach przyjmie morfologię ujemną (–) w aVR i dodatnią (+) w aVL. Dodatkowym odprowadzeniem informującym o stronie pochodzenia rytmu jest kończynowe odprowadzenie I (PP→LP = P + ; LP→PP = P – ). Jeśli po wykorzystaniu powyższych odprowadzeń nadal nie jesteśmy pewni rytmu, to warto wykorzystać jakieś odprowadzenie z wiązki przedsercowej (np. V1). Elektroda ta jest położona nad prawą komorą, ale w płaszczyźnie poziomej. Impuls wychodzący z lewego przedsionka da więc załamek P dodatni (+). Ale gdy impuls będzie wychodził z prawego przedsionka, to załamek P przyjmie morfologię dodatnio-ujemną (±). Podsumowując należy podkreślić, że rytm zatokowy spełnia kryteria „wierszyka zatokowego” (ryc. 5). W ocenie rytmu pozazatokowego wierszyk jest niespełniony, a znaczną rolę odgrywają również inne elektrody (np. aVL, V5, V6) (ryc. 6).

Ryc. 5. Ocena wiodącego rytmu serca – rytm zatokowy
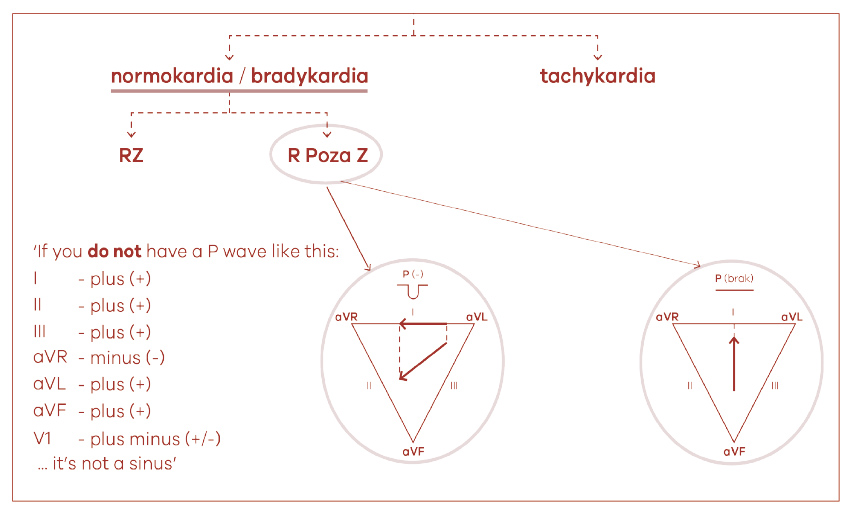
Ryc. 6. Ocena rytmu wiodącego serca – rytm pozazatokowy (przedsionkowy, węzłowy)
Krok 2 – Ocena osi elektrycznej serca
Po określeniu odpowiedniego rytmu należy określić oś elektryczną serca (ryc. 7). Oś najlepiej opisywać w oparciu o odprowadzenia kończynowe I, aVF i ewentualnie II do określenia lewogramu (patologicznego). Rozpoznanie pozwala ustalić odchylenie osi w prawo (+90 do +180 stopni), odchylenie osi w lewo (-30 do -90 stopni), oś niezdefiniowaną (-90 do -180 stopni), oś pośrednią (-30 do +90 stopni). Oś pośrednia może być najczęściej normogramowa (0 do +90 stopni) lub nieznacznie odchylona w lewą stronę (0 do -30 stopni).
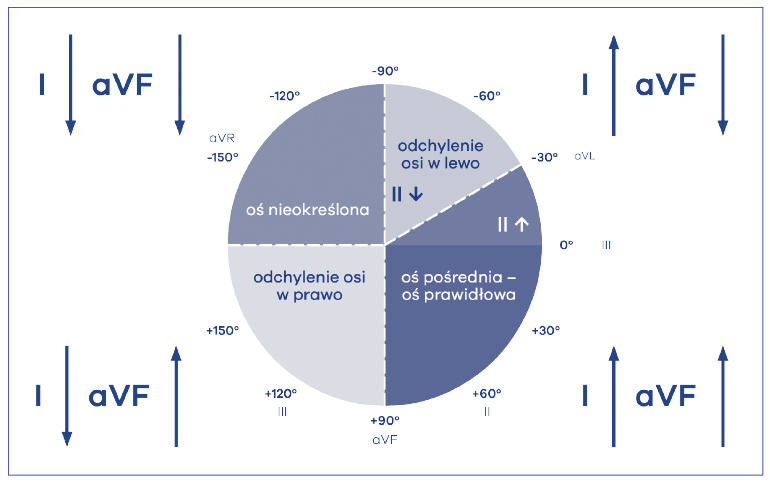
Ryc. 7. Ocena osi elektrycznej serca
Jak wspomniałem wcześniej, w najnowszych standardach odprowadzeniem dolnościennym, na podstawie którego oceniamy oś elektryczną zespołów komorowych jest odprowadzenie aVF, zamiast uprzednio stosowanego odprowadzenia III (ryc. 8). Dodatkowo usunięto pojęcie lewogramu fizjologicznego, w związku z tym nazwa normogramu przyjęła obecnie nazwę osi pośredniej, prawidłowej. Kryteria rozpoznania osi pośredniej to wychylenie QRS-u dodatnie w I i aVF (prawa połowa koła). Przy ujemnej konstelacji zespołu komorowego w aVF, ale nadal dodatnim w I, należy ocenić dodatkowe odprowadzenie, którym jest kończynowe II. Jeśli w tym odprowadzeniu QRS net będzie dodatni – rozpoznajemy oś pośrednią, natomiast przy QRS net ujemnym oś patologiczną odchyloną w lewo, czyli lewogram. Mianem lewogramu określamy zawsze lewogram patologiczny, a więc odchylenie osi od -30 do -90 stopni. Główne kryteria różnicowania z osią pośrednią przedstawiłem powyżej, natomiast główne przyczyny odchylenia osi w lewo to: blok lewej odnogi pęczka Hisa (LBBB), blok wiązki przedniej lewej odnogi pęczka Hisa (LAFB), przerost lewej komory serca (LVH), zawał ściany dolnej z martwicą (patologiczne Q w aVF), zespół preekscytacji WPW (droga dodatkowa prawostronna), hyperkaliemia, stała stymulacja komorowa (ryc. 9). Jeśli chodzi o prawogram to kryterium rozpoznania stanowią ujemne wychylenie zespołu komorowego QRS w I i dodatnie w odprowadzeniu aVF – lewa połowa koła (+90 do +180 stopni). Główne przyczyny prawogramu to: przerost prawej komory serca (RVH), blok wiązki tylnej lewej odnogi pęczka Hisa (LPFB), zawał ściany bocznej z martwicą (patologiczne Q w I), blok prawej odnogi pęczka Hisa (RBBB), zespół preekscytacji WPW (drogi dodatkowe lewostronne), przewlekła obturacyjna choroba płuc (POChP), zatorowość płucna (ZP), ubytek przegrody międzykomorowej (VSD), także jako wariant normy. Oś nieokreśloną rozpoznajemy wówczas, kiedy zespoły komorowe w odprowadzeniach kończynowych I i aVF są wychylone w dół. W anglojęzycznej terminologii jest ona określana mianem northwest axis (oś północny-zachód). Przyczyny osi nieokreślonej to głównie: częstoskurcz komorowy (VT), niespecyficzne zaburzenia przewodzenia śródkomorowego (IVCD), przerost prawej komory serca (RVH), arytmogenna kardiomiopatia prawej komory (ARVD), zawał ściany przedniobocznej z martwicą, zespoły preekscytacji WPW, hyperkaliemia, przewlekła obturacyjna choroba płuc (POChP), rytm komór stymulowany (ryc. 9). Na koniec należy dodać, że osi elektrycznej nie określa się w częstoskurczach lub gdy brak jest pobudzeń komorowych własnych – a więc w przypadku wystymulowanych zespołów QRS.
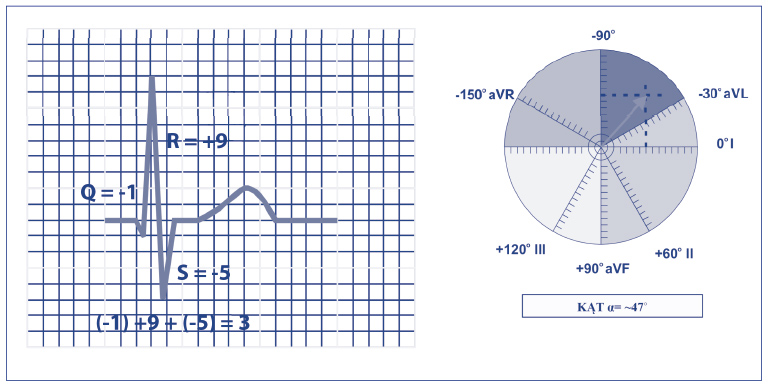
Ryc. 8. Ocena osi elektrycznej serca zespołów QRS w płaszczyźnie czołowej
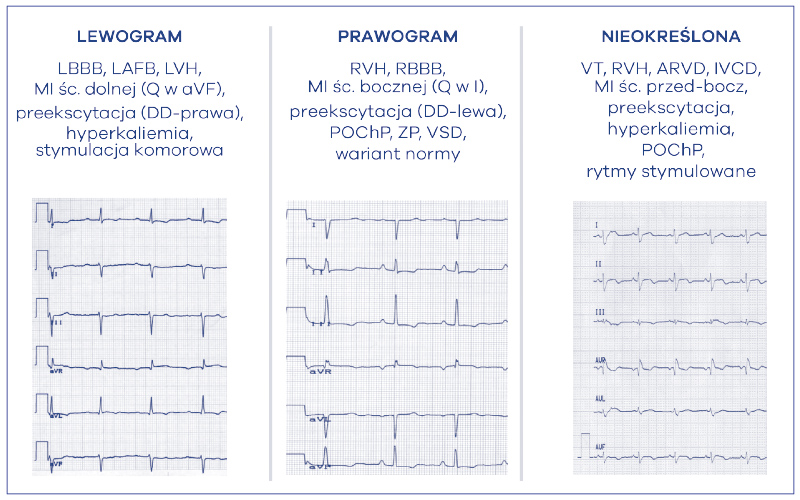
Ryc. 9. Przyczyny odchylenia osi elektrycznej serca
Krok 3 – Ocena zaburzeń przewodzenia
Trzeci krok opisu EKG zakłada ocenę zaburzeń przewodzenia – od zatokowych aż po śródkomorowe. W przedsionkach może dochodzić do zaburzeń pod postacią bloków zatokowo-przedsionkowych, jak i międzyprzedsionkowych. Bloki zatokowo-przedsionkowe rozpoznaje się po wystąpieniu nagłej zmienności rytmu serca, najczęściej nagłej bradykardii. Obserwując taką bradykardię należy zwrócić uwagę na to, jakie części elektrokardiogramu „wypadły”. Jeśli występuje blok zatokowo-przedsionkowy, to wypada załamek P, a za nim cały zespół komorowy QRS. Jeśli brakuje jedynie zespołu QRS, to mamy do czynienia z blokiem przedsionkowo-komorowym (ryc. 10).

Ryc. 10. Ocena zaburzeń przewodzenia (bloki nadkomorowe)
Rozpoznanie bloku zatokowo-przedsionkowego jest trudne, bowiem można zdiagnozować go tylko, gdy dysponujemy zapisem początku lub końca incydentu bradykardii. Klasyczny podział wyróżnia trzy stopnie bloku. Pierwszy stopień jest trudny do określenia w standardowym EKG i łudząco przypomina niemiarowość zatokową oddechową, a trzeci z kolei trudno zróżnicować z pauzą w mechanizmie zahamowania zatokowego. W bloku zatokowo-przedsionkowym pobudzenie zatokowe jest blokowane pomiędzy węzłem zatokowym a przedsionkami, w związku z tym przewodzenie przedsionkowo-komorowe (zależność P-QRS) nie zmienia się. Wielu autorów uważa więc, że w standardowym zapisie EKG nie można prawidłowo rozpoznać bloku zatokowo-przedsionkowego I stopnia właśnie z powodu powyższych zależności. Ale można go rozpoznać oznaczając czas przewodzenia zatokowo-przedsionkowego (ryc. 11). Są dwie metody: bezpośrednia (inwazyjne badanie elektrofizjologiczne) lub pośrednia (stymulacja przezprzełykowa). Z kolei profesorowie Barbara i Andrzej Dąbrowscy dość szczegółowo przedstawiają zasady interpretacji bloku z-p I stopnia tylko w oparciu o zapis elektrokardiograficzny. Do pomiarów proponują wybrać fragment elektrokardiogramu z przedwczesnym pobudzeniem przedsionkowym, które pojawia się podczas miarowego rytmu zatokowego, a przerwa poekstrasystoliczna nie ma charakteru przerwy wyrównawczej. Czas przewodzenia zatokowo-przedsionkowego (tzw. SACT – sinoatrial conduction time) można wówczas obliczyć według odpowiedniego wzoru. Jest to iloraz różnicy odstępu przerwy poekstrasystolicznej (P2P3) i podstawowego rytmu (P1P1) podzielonego przez dwa, czyli (P2P3 – P1P1)/2. Granice norm tego czasu nie są ostatecznie ustalone, można jednak przyjąć, że prawidłowy czas przewodzenia zatokowo-przedsionkowego nie przekracza 150 ms w czasie czuwania. Kiedy jest zaś dłuższy (>150 ms), wskazuje na blok z-p I stopnia.
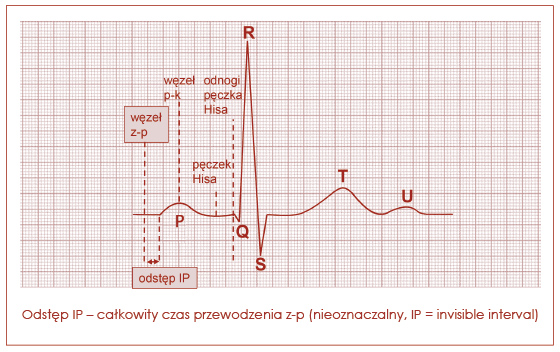
Ryc. 11. Czas przewodzenia zatokowo-przedsionkowego (odstęp IP)
Większy problem stanowi różnicowanie bloku zatokowo-przedsionkowego II stopnia. Blok zatokowo-przedsionkowy II stopnia można podzielić na cztery standardowe podtypy: periodykę Wenckebacha, periodykę 2:1, periodykę Mobitza i blok zaawansowany. Blok typu Wenckebacha stwarza dużo trudności diagnostycznych podczas oceny elektrokardiogramu i przeważnie traktowany jest nieprawidłowo jako niemiarowość zatokowa (ryc. 12). Cechą charakterystyczną tej formy bloku są powtarzające się cyklicznie, nagłe wydłużenia odstępu P3P3 poprzedzone stopniowym skracaniem się odstępów (P1P1 > P2P2). W bloku Wenckebacha ze stosunkiem przewodzenia 3:2 występują naprzemiennie krótsze i dłuższe odstępy PP. Jednakże, co ważne, morfologia kolejnych załamków P rozpoczynających krótszy i dłuższy cykl PP jest taka sama w każdym z 12 odprowadzeń rutynowego elektrokardiogramu. Cecha ta pozwala odróżnić ten typ bloku zatokowo-przedsionkowego od bigeminii przedsionkowej, w której kształt pobudzeń ektopowych i zatokowych załamków P jest różny.
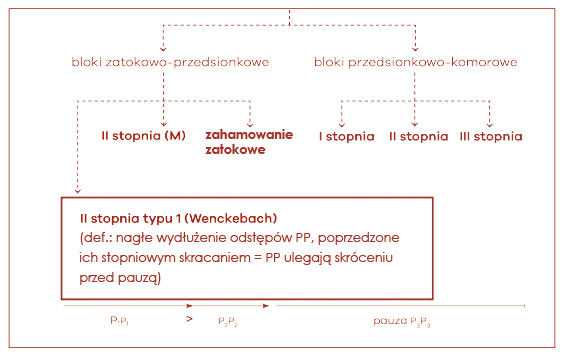
Ryc. 12. Ocena zaburzeń przewodzenia z-p (→ blok Wenckebacha)
Dalsze kryteria diagnostyczne dla bloku zatokowo- -przedsionkowego obejmują wypadanie pojedynczych kolejnych ewolucji serca (czyli całych zespołów P-QRS-T). Przerwa taka może być wielokrotnością odstępu PP rytmu podstawowego (P1P1 = P2P2). Powyższe kryteria dotyczą najczęściej rozpoznawanego bloku zatokowo-przedsionkowego II stopnia typu Mobitza (ryc. 13). Ta forma bloku prowadzi do wypadania pojedynczych ewolucji (blok 2: l), rzadziej dwóch lub trzech kolejnych ewolucji serca. Stały blok zatokowo-przedsionkowy 2:1 z wypadaniem co drugiej ewolucji daje obraz bradykardii zatokowej, zwykle o częstotliwości 40-45/min. Właściwe rozpoznanie można wówczas ustalić tylko wtedy, gdy dysponujemy zapisem początku lub zakończenia wolnego rytmu zatokowego, w którym stwierdza się odpowiednie kryteria diagnostyczne. Należą do nich: nagły początek lub nagłe ustąpienie bradykardii (1), dwukrotnie szybszy rytm zatokowy przed wystąpieniem lub po ustąpieniu bradykardii (2), pauza będąca zazwyczaj wielokrotnością odstępu PP, chociaż może być od niego dłuższa lub krótsza o 100 ms (3). Ostatnią możliwością rozpoznawczą bloku zatokowo-przedsionkowego II stopnia jest tzw. blok zaawansowany. Jest on raczej łatwy do rozpoznania, bowiem charakteryzuje się stałym odstępem PP, a przerwa jest wielokrotnością tego odstępu w stosunku większym niż jeden, czyli PP = 3:1, 4:1. W przypadku występowania zahamowania zatokowego dochodzi do nagłego wydłużenia odstępów PP poprzedzonego ich stopniowym wydłużaniem (P1P1 < P2P2) (ryc. 14).
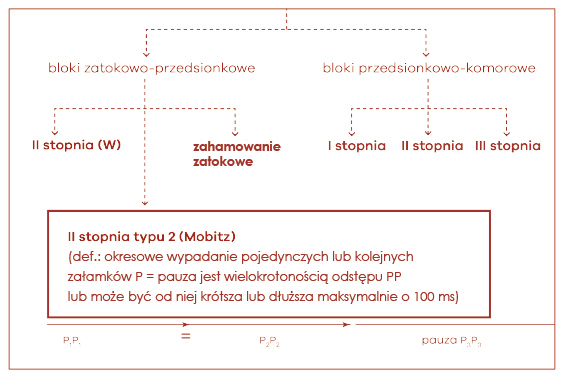
Ryc. 13. Ocena zaburzeń przewodzenia z-p (→ blok Mobitza)
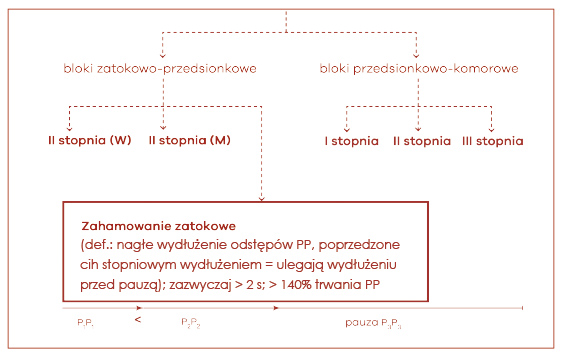
Ryc. 14. Ocena zaburzeń przewodzenia z-p (→ sinus arrest)
Bloki międzyprzedsionkowe są zaburzeniami przewodzenia występującymi pomiędzy prawym i lewym przedsionkiem. Bloki te rozpoznaje się po zmienionej morfologii załamka P. Zmienny kształt załamka P, ale przy niezmienionej częstotliwości rytmu podstawowego, przemawia za powstaniem zaburzeń przewodzenia właśnie pomiędzy przedsionkami. Może wówczas pojawić się na krzywej wysoki lub zniekształcony załamek P imitujący P pulmonale czy P mitrale u osób bez wad zastawkowych. Znamiennym kryterium rozpoznania jest nadmierne wydłużenie czasu trwania załamka P i jego dwufazowość (pierwsza faza dodatnia, a druga ujemna w odprowadzeniach II, III i aVF). Fala bowiem płynąc w kierunku węzła p-k pobudza lewy przedsionek w kierunku wstecznym, tj. od dołu ku górze, a nie jak prawidłowo z góry do dołu (ryc. 15).
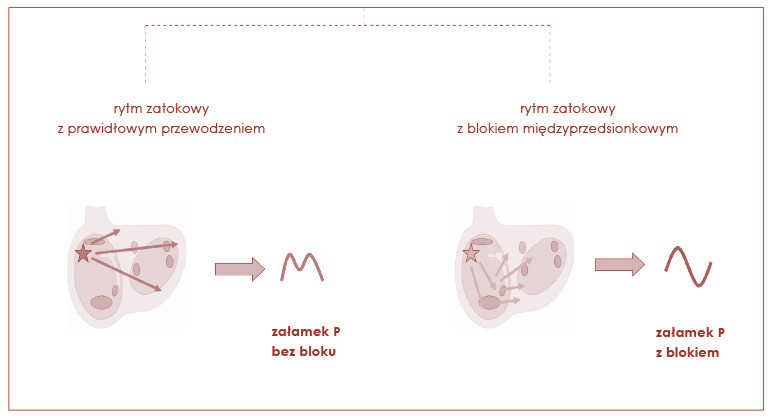
Ryc. 15. Ocena bloków międzyprzedsionkowych (IAB)
Zaburzenia obejmujące dalszą propagację impulsu w obrębie dolnej części przedsionków, a właściwie w łączu przedsionkowo-komorowym, powszechnie określa się mianem bloków przedsionkowo-komorowych. Zazwyczaj bloki tego typu nie sprawiają większych trudności rozpoznawczych – są bowiem najczęstsze. Jednak z drugiej strony, ich prawidłowa diagnostyka jest ciągle niezadowalająca. Należy zaznaczyć, że podstawowym zjawiskiem charakteryzującym zdrowe serce jest skojarzenie przedsionkowo-komorowe. Polega ono na tym, że w sercu istnieje z góry określona prawidłowa sekwencja skurczów przedsionków i komór (ryc. 16). Najpierw kurczą się przedsionki, a następnie komory. Wynika to bezpośrednio z funkcji układu przewodzącego serca i „piętrowej” działalności rozruszników w sercu. Ponieważ pierwszym i zarazem najwyższym piętrem układu bodźcotwórczego jest węzeł zatokowo-przedsionkowy, a leży on w suficie przedsionka, to najpierw pobudzane są przedsionki. Bodziec idzie dalej w dół do komory, osiągając węzeł i pęczek przedsionkowo-komorowy (tzw. łącze p-k) jako pierwsze, a dopiero później mięsień roboczy komór. Dlatego komory kurczą się najpóźniej ze wszystkich struktur serca. To daje prawidłową sekwencję skurczów przedsionków i komór. Podsumowując, droga depolaryzacji w sercu wygląda następująco:
- węzeł zatokowo-przedsionkowy,
- mięsień roboczy przedsionków,
- węzeł przedsionkowo-komorowy,
- pęczek przedsionkowo-komorowy,
- odnogi pęczka przedsionkowo-komorowego,
- włókna Purkinjego,
- mięsień roboczy komór.
Taka prawidłowa sekwencja zdarzeń określana jest właśnie mianem skojarzenia przedsionkowo-komorowego. Wyrazem tego jest prawidłowe przewodzenie przez węzeł p-k, czyli odstęp PQ (ryc. 16). Prawidłowo odstęp ten waha się w granicach 120-200 ms (0,12-0,20 s).
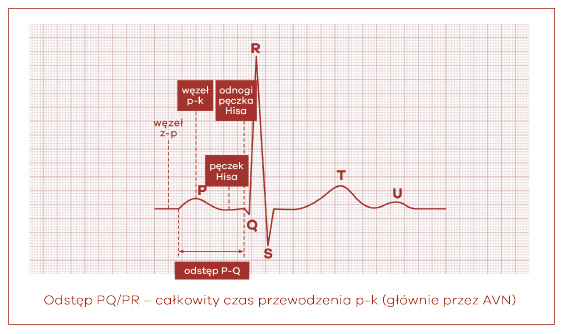
Ryc. 16. Czas przewodzenia przedsionkowo-komorowego (odstęp PQ)
Blok I stopnia jest określany utajonym, ponieważ jest wynikiem tylko wydłużenia czasu przewodzenia (ryc. 17). Podstawową cechą rozpoznania jest więc wydłużenie odcinka PQ/PR (który odpowiada przewodzeniu przedsionkowo-komorowemu) > 200 ms z zachowaniem skojarzenia przedsionkowo-komorowego. Dlatego trafnym synonimem dla bloku I stopnia jest blok utajony, ponieważ nie powoduje on żadnego blokowania impulsów i objawów klinicznych.

Ryc. 17. Ocena zaburzeń przewodzenia p-k (→ blok Io, utajony)
Blok II stopnia (blok częściowy) powoduje istotną redukcję liczby przewiedzionych bodźców, zatrzymując je na poziomie łącza przedsionkowo-komorowego (ryc. 18). Blok ten powoduje prawidłowe lub wydłużone przewodzenie co drugiego lub więcej pobudzenia. W obrębie tego bloku można wyróżnić co najmniej 4 podtypy: typ Wenckebacha, typ Mobitza, typ 2:1 i typ zaawansowany. W bloku p-k II stopnia o typie 1 (Wenckebacha lub Mobitz I) dochodzi do stałego wydłużania się przewodzenia przedsionkowo-komorowego z czasem tak znacznego, że w końcu pojedyncze pobudzenie nie może przejść do komory, czyli wypada. Typ Wenkcebacha daje wyraźne do zauważenia stopniowe wydłużania się PQ, przez co najmniej kilka impulsów (> 2).
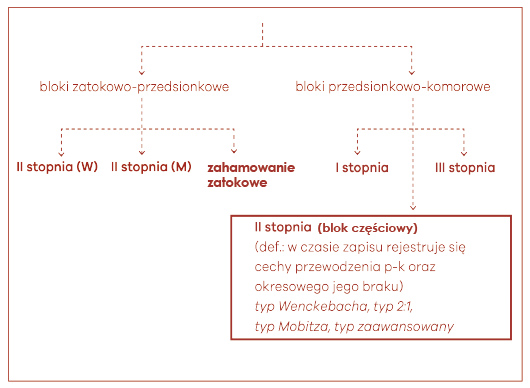
Ryc. 18. Ocena zaburzeń przewodzenia p-k (→blok IIo, częściowy)
Kolejny podtyp bloku p-k II stopnia to typ 2 (Mobitza; w literaturze amerykańskiej i kanadyjskiej zwany Mobitz II). Rozpoznajemy go wtedy, gdy nie dochodzi do stopniowego wydłużania się przewodzenia przedsionkowo-komorowego. Oznacza to, że odstęp PQ jest stały i może przyjmować prawidłowe wartości w sytuacji, kiedy zachowane jest przewodzenie. Niektóre jednak z załamków P całkowicie się nie przewodzą i w związku z powyższym nie pobudzają komory. Może się to dziać w różnych stosunkach czasowych, dlatego też blok ten przybiera formy przewodzenia, takie jak 3:2 (to znaczy występują 3 załamki P na każde 2 zespoły QRS), 4:3, 5:4, a czasem również 2:1. Blok przedsionkowo-komorowy o typie 2:1 jest jednak jakby pomiędzy wenckebachowskim a mobitzowskim, dlatego obecnie stanowi osobny podtyp w bloku p-k II stopnia.
Nie ulega wątpliwości, że rozpoznanie bloku typu Mobitza jest łatwe, gdy wypadają pojedyncze pobudzenia. Okazuje się jednak, że czasem może wypaść więcej niż tylko jedno pobudzenie. To daje nam pewne nasilenie bloku przedsionkowo-komorowego, ale z zaznaczeniem, że na pewno któreś z pobudzeń przewodzi się prawidłowo. Gdyby opisać wyliczone w ten sposób stosunki, to musiałyby się one różnić liczbą większą niż jeden. Tak więc powstaje nam blok np. 3:1, 4:1 itd. Jeśli tylko mamy pewność, że jakiś nawet pojedynczy impuls się przewiódł to musimy rozpoznać blok p-k II stopnia, zaawansowany.
Zupełne przerwanie przewodzenia to definicja bloku III stopnia, zwanego zupełnym lub całkowitym (ryc. 19). Jego rozpoznanie opieramy na tym, że żadne z pobudzeń wzbudzanych w przedsionkach nie może się przewieźć do komór. Blok III stopnia dzielimy na dwa podtypy: proksymalny i dystalny. Jeśli pobudzenia zastępcze charakteryzują się wąskimi zespołami QRS i dość szybkim, jak na rytm zastępczy, rytmem 35‑50/min, to rozpoznajemy blok proksymalny. Rytm zastępczy w bloku dystalnym zawsze pochodzi z niższych partii komory, a to daje szeroki QRS o niskiej częstotliwości 20‑35/min (ryc. 20). Najczęściej towarzyszy mu zespół MAS (Morganiego-Adamsa-Stokes’a, kardiogenna utrata przytomności), który jest nagłym stanem zagrożenia życia i bezwzględnym wskazaniem do pilnego przyjęcia do szpitala. Jeśli pacjent z MAS nie ma rytmu zastępczego (na monitorze lub w EKG widać tylko załamki P bez zespołów QRS), należy natychmiast podjąć resuscytację krążeniowo-oddechową i wezwać karetkę.
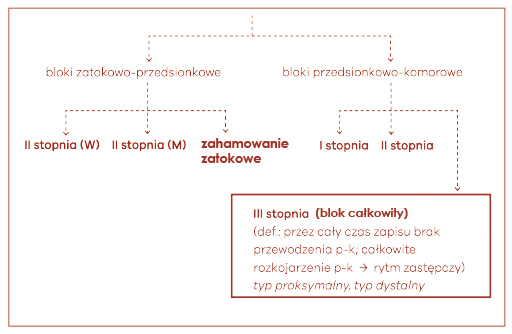
Ryc. 19. Ocena zaburzeń przewodzenia p-k (→ blok IIIo, całkowity)
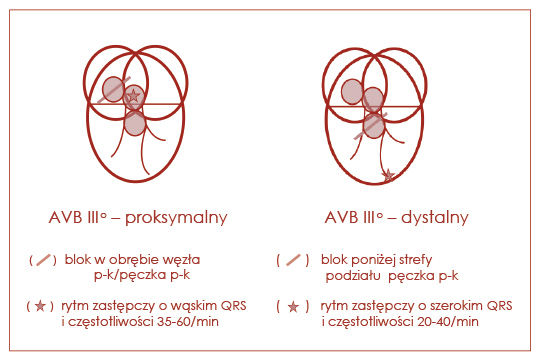
Ryc. 20. Blok przedsionkowo-komorowy całkowity (proksymalny, dystalny)
Opóźnienie lub zatrzymanie fali pobudzenia w jakimkolwiek obszarze leżącym poniżej rozwidlenia pęczka przedsionkowo-komorowego zwane jest powszechnie blokiem śródkomorowym (ryc. 21). Przyczyną bloku może być przerwanie ciągłości dróg przewodzących (odnogi pęczka Hisa, wiązki odnóg czy włókna Purkinjego) lub utrata zdolności przewodzenia wskutek nieosiągnięcia w tych włóknach potencjału progowego, który powoduje wydłużenie procesu depolaryzacji (ryc. 22). Kryterium rozpoznawcze bloku śródkomorowego w elektrokardiogramie to opóźnienie zwrotu ujemnego nad zablokowanym obszarem i poszerzenie zespołu QRS. W bloku odnogi pęczka Hisa zespół komorowy trwa zazwyczaj ponad 0,12 s. Ze względu na wypadnięcie pewnej części mięśnia sercowego ze stanu pobudzenia, w zespole komorowym wykształcają się charakterystyczne zmiany, upoważniające do rozpoznania bloku śródkomorowego.
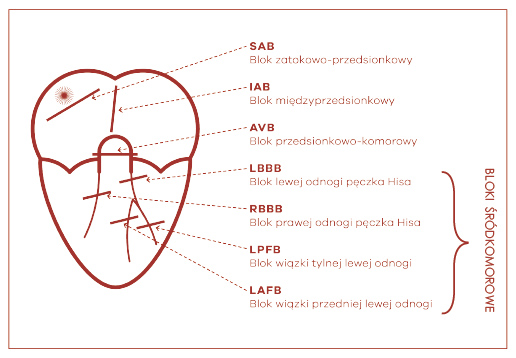
Ryc. 21. Ocena zaburzeń przewodzenia (bloki wewnątrzkomorowe)
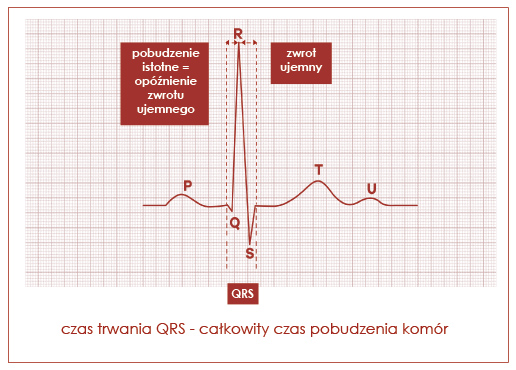
Ryc. 22. Czas przewodzenia w komorze (zespół QRS)
Aby rozpoznać blok prawej odnogi (right bundle branch block, RBBB) zapis EKG musi spełniać wszystkie poniższe kryteria (ryc. 23):
- szerokie załamki S > 40 ms lub S > R w odprowadzeniach I i V6,
- morfologia zespołu komorowego o kształcie RsR’ lub rSR’ lub rsR’ w odprowadzeniach Vl i/lub V2,
- zespół komorowy QRS poszerzony − o czasie trwania ≥ 0,12 s,
- opóźnienie zwrotu ujemnego > 50 ms w Vl oraz
- przeciwstawne wychylenie odcinka ST-T w stosunku do głównego wychylenia zespołu QRS w Vl.

Ryc. 23 Blok śródkomorowy pod postacią bloku prawej odnogi pęczka Hisa (RBBB)
Całość obrazu elektrycznego w bloku prawej odnogi wynika z tego, że początkowa część zespołu QRS jest ukształtowana prawidłowo. Dopiero po upływie 40-60 ms nieprawidłowe odchylenie średniego wektora depolaryzacji komór w prawo i ku przodowi powoduje zniekształcenie zespołu QRS z wtórnym załamkiem R w odprowadzeniach prawokomorowych i z głębokim załamkiem S w lewokomorowych. Dlatego też zespoły QRS w odprowadzeniach V1 i V2 są wysokie, zazębione, najczęściej typu rsR lub rSR. Niekiedy składają się tylko z szerokiego, zazębionego na szczycie załamka R lub przybierają postać qR. W odprowadzeniach I i II – oraz w przedsercowych lewokomorowych zespoły QRS składają się z wąskiego załamka R i szerokiego, ,,łopatowatego” załamka S. Kąt nachylenia osi elektrycznej serca w płaszczyźnie czołowej przeważnie jest prawidłowy, rzadziej oś elektryczna odchylona jest w prawo, ale może również być odchylona w lewo. W sytuacji, gdy spełnione są warunki dla rozpoznania bloku prawej odnogi (odpowiedni kształt krzywej), lecz szerokość zespołu QRS jest mniejsza od 0,12 s, ale większa od 0,10 s, należy rozpoznać blok niezupełny.
Aby móc rozpoznać zupełny blok lewej odnogi (left bundle branch block, LBBB), zapis EKG musi spełniać wszystkie poniższe kryteria (ryc. 24):
- szeroki zazębiony załamek R w odprowadzeniach V5, V6, I i aVL,
- brak załamka Q w I, V5 i V6,
- zespół komorowy QRS poszerzony (≥ 0,12 s),
- opóźnienie zwrotu ujemnego > 60 ms w odprowadzeniach V5 i V6 ewentualnie w I i/lub aVL,
- przeciwstawne wychylenie odcinka ST-T w stosunku do głównego wychylenia zespołu QRS w VS-V6.
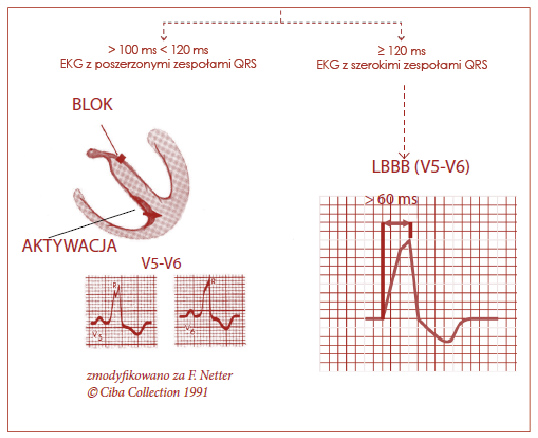
Ryc. 24. Blok śródkomorowy pod postacią bloku lewej odnogi pęczka Hisa (LBBB)
W bloku przedniej wiązki (left anterior fascicular block, LAFB) muszą być spełnione wszystkie wymienione poniżej kryteria (ryc. 25):
- lewogram (oś zespołu QRS od -45 do -90°),
- morfologia zespołu komorowego o typie qR w odprowadzeniu aVL,
- czas do szczytu załamka R, czyli opóźnienie zwrotu ujemnego, w odprowadzeniu aVL ≥ 45 ms,
- czas trwania całości zespołu QRS < 120 ms (z wyjątkiem współistniejącego RBBB).
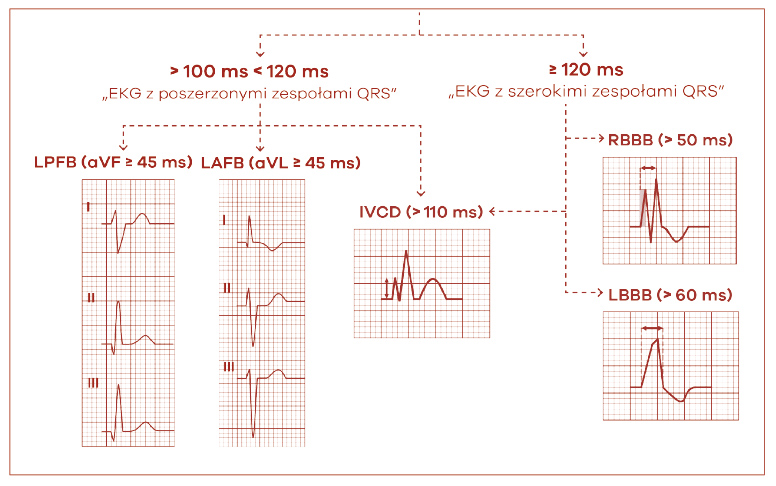
Ryc. 25. Blok śródkomorowy pod postacią bloków wiązek lewej odnogi pęczka Hisa (LAFB, LPFB) i bloków niespecyficznych (IVCD)
Lewogram może być spowodowany nie tylko zaburzeniami przewodzenia w przedniej wiązce lewej odnogi pęczka Hisa, ale m.in. zawałem ściany dolnej, przerostem lewej komory, preekscytacją. W niektórych przypadkach nie da się odróżnić poszczególnych patologii dających lewogram. Również problemem jest sytuacja, gdy występują jednocześnie dwie przyczyny odchylenia osi w lewo − blok przedniej wiązki i zawał ściany dolnej. Obecność lewogramu oraz patologicznych załamków w Q w odprowadzeniach II, III, aVF przemawia za rozpoznaniem cech martwicy ściany dolnej. Jako dodatkowe kryterium rozpoznania bloku przedniej wiązki podaje się obecność zespołu rS w odprowadzeniach II, III, aVF. Wystąpienie bowiem bloku przedniej wiązki lewej odnogi w istotnym stopniu wpływa na amplitudy załamków R w obu grupach odprowadzeń: kończynowych (amplituda załamków R wzrasta) i w przedsercowych (nieprawidłowa progresja i zmniejszenie amplitudy w odprowadzeniach lewokomorowych). Konsekwencją tego zjawiska jest przede wszystkim konieczność zastosowania innych kryteriów rozpoznawania przerostu lewej komory.
Podobnie jak w bloku opisanym powyżej, aby rozpoznać blok tylnej wiązki lewej odnogi (left posterior fascicular block, LPFB) należy spełnić wszystkie kryteria (ryc. 25):
- prawogram (oś zespołu QRS od +90 do +180°),
- morfologia zespołów qR w odprowadzeniach III i aVF,
- zespoły rS w odprowadzeniach I i aVL,
- czas do szczytu załamka R, czyli opóźnienie zwrotu ujemnego, w odprowadzeniu aVF ≥ 45 ms,
- czas trwania zespołu QRS < 120 ms (z wyjątkiem współistniejącego RBBB) i
- brak cech przerostu prawej komory (brak RVH).
W bloku tylnej wiązki załamek q w odprowadzeniach III i aVF nie musi spełniać żadnych wartości granicznych dotyczących jego szerokości i amplitudy. W przypadku, gdy te wartości przekroczą granicę normy (patologiczny załamek Q) należy rozpoznać zawał i blok tylnej wiązki. Rozpoznanie bloku tylnej wiązki jest niemożliwe w przypadku, gdy szerokość zespołu QRS przekracza 120 ms. Wyjątek stanowią zapisy, w których stwierdza się RBBB. Należy wtedy opisać oba rodzaje zaburzeń przewodzenia śródkomorowego.
Krok 4 – Ocena przerostów jam serca
Czwarty krok opisu elektrokardiogramu to ocena przerostów – komór i przedsionków. Jeśli chodzi o ostatnie z wymienionych to oprócz terminu „przerost przedsionka” można się spotkać z określeniem „powiększenie przedsionka”. Termin „przerost” stosowano dawniej, ale z przeprowadzonych badań wynika, iż możemy jedynie stwierdzić, że depolaryzacja mięśnia przedsionków następuje zmienionym szlakiem. Nie można więc określić, czy zmienione przewodzenie wewnątrzprzedsionkowe wynika z jego przerostu, czy z rozstrzeni, a więc terminologia uległa zmianie na atrial enlargement (ryc. 26).
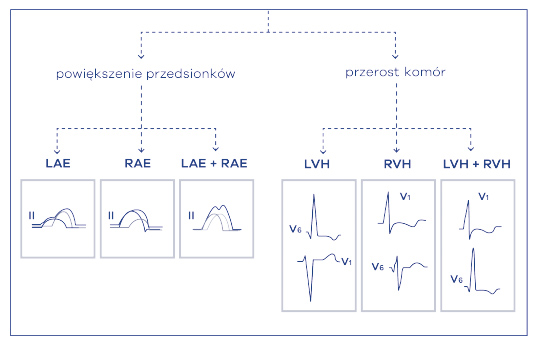
Ryc. 26. Ocena powiększenia przedsionków i przerostów komór w EKG
Cechą powiększenia/przerostu prawego przedsionka (RAE − right atrial enlargement) jest występowanie załamka P o specyficznych cechach, zwanego powszechnie P-pulmonale (ryc. 27A). Kryteria rozpoznawcze takiego załamka to: wysoki > 2,5 mm załamek P w co najmniej jednym odprowadzeniu kończynowym i wysoki > 1,5 mm P w V1 lub V2. Załamek P jest wówczas spiczasty, namiotowaty i wysoki. Jest to obraz typowy dla dużego powiększenia prawego przedsionka. Takie załamki P są najlepiej widoczne i najczęstsze w odprowadzeniach II i III. Załamek P może być spiczasty, ale nie mieć 2,5 mm wysokości. Jeżeli spiczaste załamki P są niższe niż 2,5 mm, nie wiążą się z powiększeniem przedsionka.
P pulmonale często wiąże się z odchyleniem osi elektrycznej w prawo, co wynika z tego, że choroba dotycząca prawej połowy serca przesuwa oś serca do prawogramu. Taka sytuacja powoduje zmiany w EKG, które mogą wynikać też z przerostu prawej komory (RVH), ale są nie do odróżnienia od LPFB. Blok wiązki tylnej lewej odnogi pęczka Hisa jest rozpoznaniem przez wykluczenie. Jakiekolwiek zmiany odpowiadające chorobie prawego przedsionka lub prawej komory wykluczają to rozpoznanie elektrokardiograficzne.
Z kolei cechy powiększenia/przerostu przedsionka lewego (LAE − left atrial enlargement) dają odpowiedni kształt załamka P określanego mianem P-mitrale. Kryteria rozpoznawcze to czas trwania P > 120 ms, czas pomiędzy dwoma zagarbionymi szczytami ≥ 40 ms lub dodatnio-ujemny albo ujemny załamek P w Vl (faza ujemna min. 0,04 s/głębokość 1 mm).
Dwugarbność jest spowodowana wydłużeniem czasu potrzebnego do przewodzenia pobudzenia przez powiększony lewy przedsionek. Impuls zatokowy szybko przewodząc się przez prawidłowy prawy przedsionek dłużej pobudza powiększony lewy przedsionek. Efektem jest podwójny wierzchołek załamka P w odprowadzeniu II. Dwugarbne mogą być również załamki P krótsze niż 0,12 s. W takich przypadkach nie wiąże się to z powiększeniem lewego przedsionka (ryc. 27B).

Ryc. 27. Powiększenie przedsionków serca. A – powiększenie prawego przedsionka (RAE), B – powiększenie lewego przedsionka (LAE)
Załamki P częst bywają szerokie i dwufazowe w odprowadzeniu V1. Taki obraz świadczy o zaburzeniach przewodzenia w przedsionkach wywołanych najczęściej ich powiększeniem. Nie można wówczas jednoznacznie stwierdzić, który przedsionek jest powiększony. Istnieją jednak dwie sytuacje, w których taki dwufazowy załamek P ułatwia różnicowanie między powiększeniem lewego przedsionka, a powiększeniem prawego przedsionka.
Jeśli pierwsza składowa dwufazowego załamka P w odprowadzeniu V1 jest wyższa od pierwszej połowy załamka P w odprowadzeniu V6, wówczas prawdopodobnym jest występowanie powiększenia prawego przedsionka (RAE). Jeśli druga połowa załamka P jest szersza i głębsza niż 0,04 s, to wtedy bardziej prawdopodobne jest powiększenie lewego przedsionka (LAE). I dodatkowo, jeśli iloczyn wysokości oraz szerokości drugiej połowy załamka P wynosi co najmniej 0,3 (głębokość [mm] x szerokość [s] = 0,3 mm x s), to też świadczy o powiększeniu lewego przedsionka (LAE).
Oczywiście w przypadku przedsionków może dojść do przerostu/powiększenia obydwu jam. Równoczesne spełnienie kryteriów przerostu (poszerzenia, powiększenia) dla lewego i prawego przedsionka, nawet w różnych odprowadzeniach, stanowi o wspólnym przeroście obydwu przedsionków.
Do rozpoznania przerostu lewej komory (LVH) najczęściej stosowane kryteria woltażu to: wskaźnik Cornell (suma S-V3 + R aVL > 28 mm (♂), > 20 mm (♀) oraz wskaźnik Sokołowa-Lyona S-V1 + R-V5/V6 > 35 mm
( > 40 r.ż.), > 40 mm (30‑40 r.ż.), > 60 mm (16-30 r.ż.). Znane są również inne kryteria, np. R-V5 > 26 mm, R-V6 > 20 mm, suma maksymalnego R + S w jakimkolwiek przedsercowym > 45 mm czy w odprowadzeniach kończynowych suma S-II + R-I > 26 mm, R-aVL > 12 mm (wyj. LAFB), R-I > 14 mm, S-aVR > 15 mm i opóźniony zwrot ujemny > 0,05 (V5, V6). Ważne są też wskaźniki: Lewisa – suma R – I i S – III > 2,5 mV (25 mm) oraz McPhie'a – suma S – V2 i R – V5/V6 > 4,5 mV (45 mm) (ryc. 28).

Ryc 28. Przerost lewej komory serca (LVH)
Wszystkie wyżej wymienione kryteria amplitudowe nie mają wysokiej czułości, dlatego też w rozpoznaniu uwzględnia się również (1) współistnienie zmian odcinka ST i załamka T świadczące o istotnym przeciążeniu lewej komory, (2) zmiany pod postacią załamka P-mitrale, (3) odchylenie osi elektrycznej w lewo i (4) wydłużenie czasu pobudzenia istotnego nad lewą komorą powyżej 45 ms. Kryteria powyższe zostały zebrane przez Romhilta i Estesa, i odpowiednio sklasyfikowane punktowo. Liczba punktów ≥ 5 pozwala rozpoznać przerost lewej komory nawet bez spełnionych kryteriów amplitudowych czy przeciążeniowych, zaś = 4 pozwala rozpoznać prawdobodobny przerost komory. Poniżej 3 punktów przerost jest mało prawdopodobny i nie rozpoznaje się go w takiej sytuacji (ryc. 28).
Znacznie trudniejsze kryteria rozpoznawcze obejmują LVH w przypadku istnienia zaburzeń przewodzenia śródkomorowego. Jeśli przerostowi towarzyszy zaburzenie przewodzenia wewnątrzkomorowego pod postacią LBBB, to wówczas musi być spełnione co najmniej jedno kryterium z wymienionych. Są to: albo suma amplitudy załamka S w odprowadzeniu V1 i załamka R w odprowadzeniu V5 > 45 mm, albo suma amplitudy załamka S w odprowadzeniu V2 i załamka S w odprowadzeniu V3 > 60 mm, albo suma amplitudy załamka S w odprowadzeniu V2 i załamka R w odprowadzeniu V5 lub V6 > 40 mm. Pomocniczym kryterium jest obecność cech przerostu lewego przedsionka i czas trwania zespołu QRS > 155 ms (ryc. 28). Jeśli przerostowi towarzyszy jedynie LAFB do rozpoznania przerostu lewej komory konieczne jest wówczas spełnienie jednego z następujących kryteriów: albo suma amplitudy załamka S w odprowadzeniu III i maksymalna suma amplitudy załamków R i S z jednego z odprowadzeń przedsercowych > 28 mm (♀) i > 30 mm (♂), albo suma amplitudy załamka S w odprowadzeniu V1 lub V2, złamka R w odprowadzeniu V6 i załamka S w odprowadzeniu V6 > 25 mm. Jeśli przerostowi towarzyszy blok prawej odnogi pęczka Hisa (RBBB) to wówczas musi być spełnione co najmniej jedno kryterium z poniższych: albo załamek R w odprowadzeniu kończynowym I > 11 mm, albo załamek R w odprowadzeniu V5 lub V6 > 15 mm.
Kryteria przerostu prawej komory (RVH) to: dominujący R-V1 ≥ 7 mm, suma R-V1 + S-VS lub V6 >10,5 mm, stosunek R/S w V1 >1 lub R/S w V5/V6 1, rSR’ w V1 z R’ >10 mm, qR complex w Vl oraz opóźniony zwrot ujemny > 0,035 (V1, V2), głębokie S, ale < 0,05 s w V5 i V6 i ST obniżony skośnie w dół, T ujemny, niesymetryczny, ujemno-dodatni, a w V1,V2 niesymetryczny, ujemno-dodatni (ryc. 29).

Ryc. 29. Przerost prawej komory serca (RVH)
Inne kryteria to: suma amplitudy załamka R w odprowadzeniu V1 i załamka S w V5 lub V6 > 1,05 mV (10,5 mm) (wskaźnik Sokolov'a). Do kryteriów pozaamplitudowych należą: odchylenie osi w prawo powyżej +110 stopni, które jest jednym z najczulszych i najwcześniejszych oznak przerostu prawej komory, cechy przerostu przedsionka prawego oraz zmiany ST-T w odprowadzeniach prawokomorowych, będące wyrazem jej przeciążenia.
Sprawa rozpoznania przerostu RVH ma się zupełnie inaczej, jeśli współistnieją zaburzenia przewodzenia śródkomorowego. Jeśli przerostowi towarzyszy blok lewej odnogi pęczka Hisa (LBBB), to muszą być spełnione co najmniej 2 z poniższych kryteriów – albo 1) stosunek R/S w odprowadzeniu V5 powinien być mniejszy od jedności, albo 2) obecność załamka R w końcowej części zespołu komorowego w aVR, albo 3) woltaż wszystkich odprowadzeń kończynowych < 6 mm. Jeśli przerostowi RVH towarzyszy blok prawej odnogi pęczka Hisa (RBBB), to wówczas musi być spełnione jedno kryterium – załamek R w odprowadzeniu V1 > 15 mm.
Natomiast, aby rozpoznać przerost obydwu komór musi być spełnione przynajmniej jedno kryterium dla przerostu prawej (RVH) i jedno dla przerostu lewej komory (LVH) (ryc. 30). Innym kryterium przerostu obydwu komór jest przerost lewej komory współistniejący z obecnością głębokich załamków S w V5 lub V6 albo współistniejący z osią serca skręconą w prawo i wysokimi dwufazowymi zespołami QRS w kilku odprowadzeniach. Takie właśnie zmiany są dość charakterystyczne dla pacjentów z wrodzonymi wadami serca. Jest to obecność wysokich dwufazowych zespołów RS w odprowadzeniach przedsercowych V2, V3, V4, co nosi nazwę objawu Katz-Wachtela.

Ryc. 30. Przerost obu komór serca (LVH + RVH)
Krok 5 – Ocena niedokrwienia
Piąty krok to ocena odcinka ST (1) oraz załamka T (2), a także patologicznych załamków Q – pod kątem ostrych zespołów wieńcowych (dławicy niestabilnej UA, zawału serca STEMI i NSTEMI), jak i cech martwicy (przebytego STEMI). Podstawowym dokumentem regulującym zasady rozpoznania niedokrwienia serca jest Czwarta Uniwersalna Definicja Zawału. Patognomoniczne dla rozpoznania ostrego zespołu wieńcowego (OZW, acute coronary syndrome ACS) jest przedłużone w czasie (np. > 20 min) nowe uniesienie odcinka ST, zwłaszcza występujące z przeciwstawnym (reciprokalnym) obniżeniem odcinków ST w innych odprowadzeniach. Zwykle odpowiada to ostremu zamknięciu tętnicy wieńcowej i powoduje uszkodzenie mięśnia sercowego z martwicą. Dodatkowe nieprawidłowości EKG występujące przy niedokrwieniu mięśnia sercowego lub w ostrym zawale serca mogą dotyczyć, oprócz wyżej wymienionych, odcinka PR i/lub zespołu QRS. Najwcześniejsze objawy niedokrwienia mięśnia sercowego to zazwyczaj zmiany w obrębie załamka T i odcinka ST. Duże dodatnie załamki T (tzw. hyperacute T wave), z wysokimi, symetrycznymi ramionami w co najmniej dwóch sąsiednich odprowadzeniach są wczesnymi objawami ostrego epizodu wieńcowego i mogą poprzedzać uniesienie odcinka ST (ryc. 31).

Ryc. 31. Zmiany odcinka ST i załamka T sugerujące ostry zespół wieńcowy
Należy zauważyć, że bardzo rzadko ostre niedokrwienie mięśnia sercowego może przyczynić się do znamiennego przemieszczenia odcinka ST spełniającego kryteria w jednym odprowadzeniu, przy jednoczesnym przemieszczeniu odcinka ST w sąsiednich odprowadzeniach nieznacznie poniżej wymaganych kryteriów. Należy również pamiętać, że przemieszczenie ST lub odwrócenie załamka T w mniejszym stopniu niż standardowe kryteria nie wyklucza ostrego niedokrwienia mięśnia sercowego lub ewolucji zawału. W czasie epizodu ostrych dolegliwości ze strony klatki piersiowej, pseudonormalizacja uprzednio odwróconych załamków T może także wskazywać na ostre niedokrwienie mięśnia sercowego. Przemijające załamki Q można obserwować w czasie epizodu ostrego niedokrwienia lub (rzadko) w czasie ostrego zawału po udanej reperfuzji. W diagnostyce różnicowej należy jednak uwzględnić:
- zatorowość płucną,
- proces śródczaszkowy,
- zaburzenia elektrolitowe,
- hipotermię,
- zapalenie osierdzia,
- zapalenie mięśnia sercowego.
Dlatego, interpretując i opisując EKG należy zdecydować (w powiązaniu z poprzednimi krokami), czy odcinek ST-T wykazuje zmiany: pierwotne (istotne, charakterystyczne dla niedokrwienia), wtórne (zależne od innych przyczyn, np. zaburzenia frontu depolaryzacji w zespołach preekscytacji), niespecyficzne (które nie spełniają kryteriów normy ani zmian istotnych, ani wtórnych) czy przetrwałe (wynikające z przebytych zespołów wieńcowych).
Kolejną istotną częścią krzywej EKG w analizie zespołów wieńcowych jest punkt łączący zespół QRS z odcinkiem ST – punkt J. Punkt J jest wykorzystywany do określenia wielkości przesunięcia odcinka ST. W przypadku wszystkich odprowadzeń, poza V2 i V3, wymagane jest nowe lub przypuszczalnie nowe uniesienie w punkcie J ponad 0,1 mV (czyli 1 mm). U zdrowych mężczyzn < 40. r.ż. uniesienie punktu J może wynosić aż 0,25 mV w odprowadzeniach V2 lub V3, a wielkość uniesienia zmniejsza się wraz z wiekiem. Ze względu na różnice między płciami wymagane są różne punkty odcięcia dla kobiet (0,15 mV), ponieważ uniesienie punktu J u zdrowych kobiet w odprowadzeniach V2 i V3 jest mniejsze niż u mężczyzn (ryc. 32).
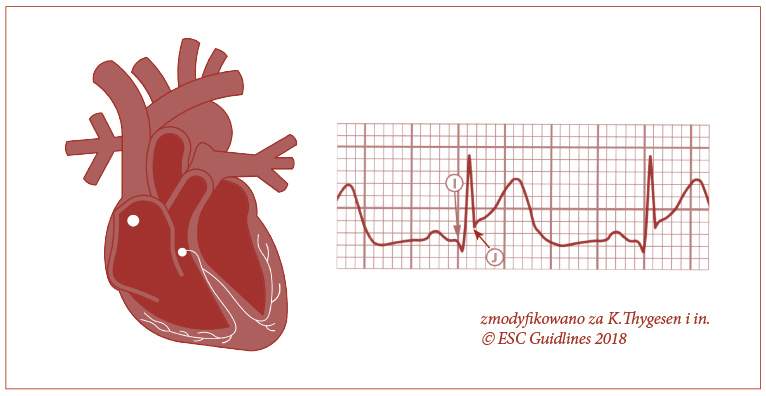
Ryc. 32. Punkty łączące J i I służące ocenie przesunięcia odcinka ST
Nowym dodanym punktem na krzywej EKG jest punkt I. Jest to początek zespołu komorowego QRS i jak się obecnie uważa najstabilniejsza część krzywej EKG.
To właśnie ten punkt stanowi wyznacznik uniesienia lub obniżenia odcinka ST w przypadku trudności diagnostycznych, zwłaszcza takich, w których prawidłowo horyzontalny odcinek TP jest odchylony od linii izoelektrycznej (ryc. 32).
Całość zmian niedokrwiennych dotyczy odprowadzeń sąsiednich, czyli dotyczących tej samej ściany serca. Pojęcie „sąsiednie odprowadzenia” odnosi się do grup odprowadzeń, takich jak: odprowadzenia przednie (V1–V6), odprowadzenia dolne (II, III, aVF) lub odprowadzenia boczne (I, aVL). Dodatkowe odprowadzenia, takie jak V3R i V4R, odpowiadają wolnej ścianie prawej komory, a V7–V9 ścianie dolno-podstawnej (ryc. 33). Kryteria wymagają, by zmiany ST były obecne w dwóch lub większej liczbie sąsiednich odprowadzeń (ryc. 34). Na przykład, uniesienie ST > 0,2 mV w odprowadzeniu V2 i > 0,1 mV w odprowadzeniu V1 spełnia kryteria nieprawidłowości w dwóch sąsiednich odprowadzeniach u mężczyzny > 40. r.ż., ale uniesienie ST < 0,1 mV i < 0,2 mV obecne tylko w odprowadzeniach V2–V3 u mężczyzn (lub < 0,15 mV u kobiet) może być prawidłowe (ryc. 35).
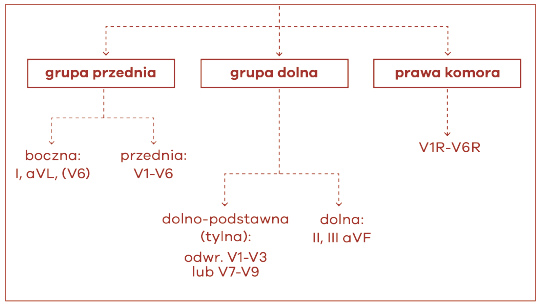
Ryc. 33. Współczesne ujęcie nazewnictwa ścian serca
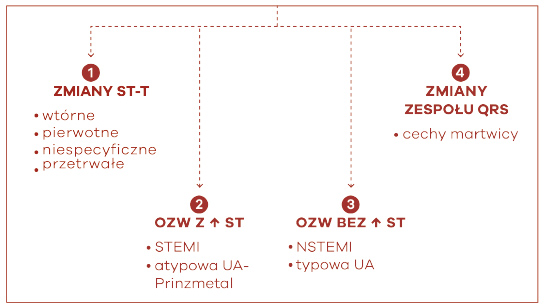
Ryc. 34 Zmiany zespołu ST-T w ostrych zespołach wieńcowych (OZW)

Ryc. 35. Ostry zespół wieńcowy z uniesieniem ST
Brak cech uniesienia odcinka ST nie świadczy o braku niedokrwienia mięśnia sercowego. W takich przypadkach oceniamy obniżenie ST oraz zmiany załamka T. Nowe obniżenie ST ≥ 0,5 mm w dwóch sąsiadujących odprowadzeniach i/lub inwersja załamka T > 1 mm, także w dwóch sąsiadujących elektrodach z dominującym załamkiem R lub stosunkiem R/S > 1 są wystarczającym kryterium rozpoznawczym (ryc. 36). Należy przede wszystkim zwrócić uwagę na wysokie, dominujące, symetryczne załamki T w odprowadzeniach przedsercowych (> 1 mm), uniesienie ST w aVR (> 1 mm) lub symetryczne, głębokie (> 2 mm) załamki T w przedsercowych → zamknięcie LAD. Samo uniesienie ST w aVR > 1 mm może być obecne w STEMI ściany dolnej lub przedniej. Zawał przedsionków powinien być brany pod uwagę, zwłaszcza w zawale prawej komory, jeśli obserwuje się przejściowe uniesienie lub obniżenie odcinka PR (PTa) bez równoczesnych zmian załamka P.
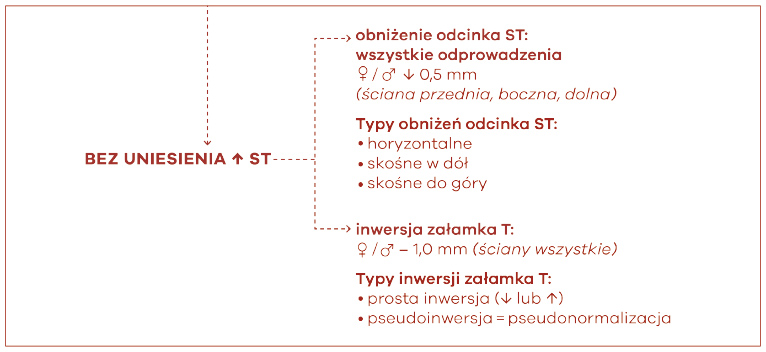
Ryc 36. Ostry zespół wieńcowy bez uniesienia ST
W przypadku obecności bloku lewej odnogi pęczka Hisa (LBBB) rozpoznanie ostrego zawału serca jest trudniejsze. Przy rozpoznawaniu w tej sytuacji mogą być pomocne uniesienia odcinka ST w tym samym kierunku co wychylenie zespołu QRS o co najmniej 1 mm. Jeśli jednak zespoły QRS będą wychylone przeciwnie do uniesienia (czyli w dół) muszą spełniać kryterium co najmniej 5 mm w punkcie J. Co ważne, w LBBB nie ma kryterium sąsiadujących odprowadzeń – wystarczy ocena jednego odprowadzenia (1 z 12). Obniżenie ST musi spełniać kryterium 1 mm w punkcie J. U pacjentów z blokiem prawej odnogi pęczka Hisa (RBBB) często występują nieprawidłowości dotyczące ST–T w odprowadzeniach V1–V3. Są to zazwyczaj: uniesienie ST lub załamki Q.
Niezależnie od objawów klinicznych, załamki Q lub zespoły QS przy braku czynników zaburzających morfologię QRS są patognomoniczne dla martwicy serca u pacjentów z chorobą niedokrwienną serca (ryc. 37). Swoistość rozpoznania przebytego OZW na podstawie EKG jest największa, gdy załamki Q występują w kilku odprowadzeniach lub grupach odprowadzeń. Jeśli załamki Q współistnieją ze zmianami ST lub zmianami załamków T w tych samych odprowadzeniach, prawdopodobieństwo przebytego zawału jest zwiększone, ale nie pewne. Dotyczy to załamków Q, które są małe i przyjmują wartości > 0,02 s i < 0,03 s, a głębokość < 0,1 mV. Takie załamki zazwyczaj wskazują na przebyty zawał, jeśli towarzyszy im odwrócenie załamków T w tej samej grupie odprowadzeń. Dlatego EKG nie jest narzędziem oceniającym czas, który upłynął od incydentu OZW i z tego powodu często używa się opisów martwicy o nieznanym czasie trwania.
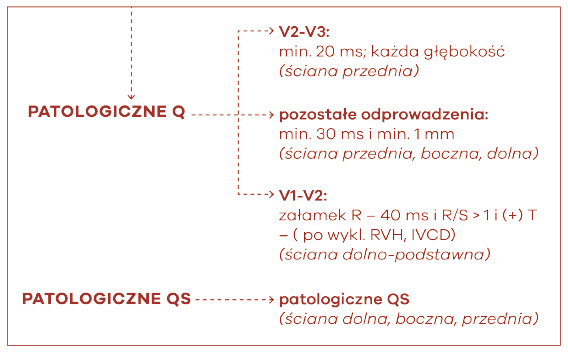
Ryc. 37. Cechy martwicy
Mimo że EKG jest bardzo niedokładnym narzędziem w ocenie czasu dokonania zawału, nie można jednak wszystkich zapisów EKG z cechami niedokrwienia serca traktować jako potwierdzenie OZW. Ocena uniesienia ST może jednak stwarzać problemy ze względu na pułapki, które niestety są przyczyną błędów. Do najczęstszych należy z pewnością poszerzony zespól QRS w przebiegu zaburzeń przewodzenia śródkomorowego (bo występują zmiany wtórne odcinka ST-T) czy choćby wydłużenie odstępu QT (bo zmienia się morfologia T). Pamiętajmy, że EKG to tylko jedno z badań dodatkowych, które sugeruje obecność (lub brak) niektórych patologii, a ostateczne rozpoznanie kliniczne jest sumą wielu innych informacji. Dlatego oprócz opisu należy, po włączeniu informacji dodatkowych, przeprowadzić cały tok klinicznego myślenia. Dopiero całość ukierunkuje nas na prawidłowe rozpoznanie (ryc. 38).

Ryc. 38. Załamki Q niepatologiczne
Krok 6 – Ocena zaburzeń rytmu serca
W przypadku szybkich rytmów serca > 100/min, najważniejsze jest rozróżnienie częstoskurczów „miarowych”, czyli typowych tachykardii, od „niemiarowych”, czyli atypowych (ryc. 39). Algorytm „miarowy” różnicuje częstoskurcze na te z wąskimi zespołami komorowymi (dokładnie ustala pochodzenie arytmii) i z szerokimi zespołami komorowymi (ustala jedynie pochodzenie komorowe lub nie). Algorytm różnicujący częstoskurcze z wąskimi zespołami jest tak ułożony, że krok po kroku w oparciu o charakterystyczne zmiany dla danego typu częstoskurczu ustala prawidłowe rozpoznanie (algorytm Kozłowskiego). Nowy, znacznie uproszczony algorytm różnicowania częstoskurczów z szerokimi zespołami QRS, powstał właściwie niedawno. Częstoskurcze z szerokimi zespołami QRS są arytmiami o bardzo ważnym znaczeniu klinicznym, zwłaszcza w aspekcie prognostycznym. BCT mogą bowiem mieć ognisko w komorze i są wtedy częstoskurczem komorowym, ale mogą być również pochodzenia nadkomorowego (przewodzą się wówczas z blokiem odnogi pęczka Hisa lub przez drogę dodatkową odpowiedzialną za zespół preekscytacji). Ponieważ większość częstoskurczów z szerokimi zespołami jest pochodzenia komorowego, do szybkiego ich różnicowania służy algorytm Vereckei.
Ryc. 39. Ocena rytmu serca w częstoskurczach
Podstawą w analizie miarowych częstoskurczów jest uważne poszukiwanie i znalezienie załamków świadczących o aktywności poszczególnych jam serca podczas tachykardii. Dla częstoskurczów z wąskimi zespołami jest to znacznie łatwiejsze, natomiast z szerokimi trudniejsze. Pierwsza istotna sprawa – algorytm na wąskie-miarowe-QRS jest tak ustawiony, aby po jego zastosowaniu precyzyjnie rozpoznać typ częstoskurczu. Dlatego najpierw należy mieć pewność, że analizowany częstoskurcz jest miarowy (ryc. 40). Rozpoznać go można po miarowych odstępach RR, czyli po czynności komór. W następnym kroku należy skupić się na czynności przedsionków.
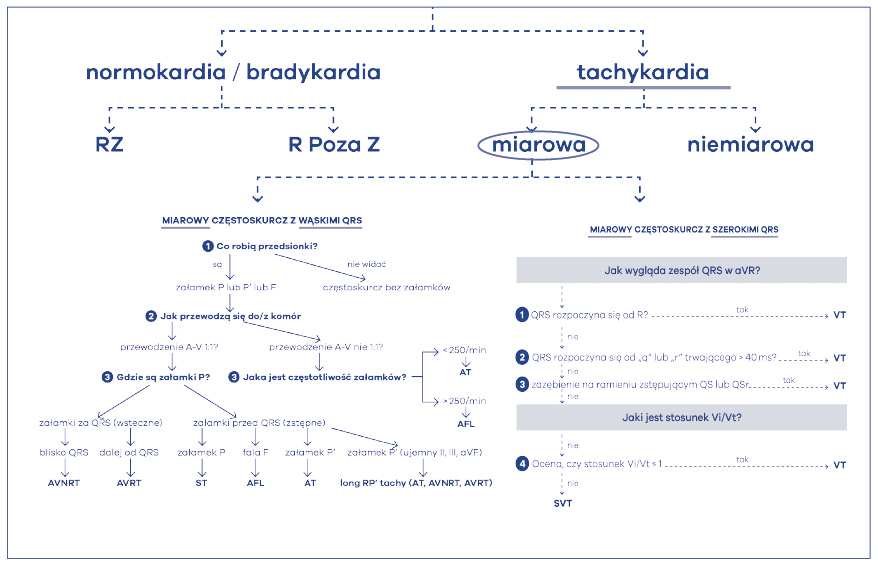
Ryc. 40. Algorytm postępowania w miarowych częstoskurczach
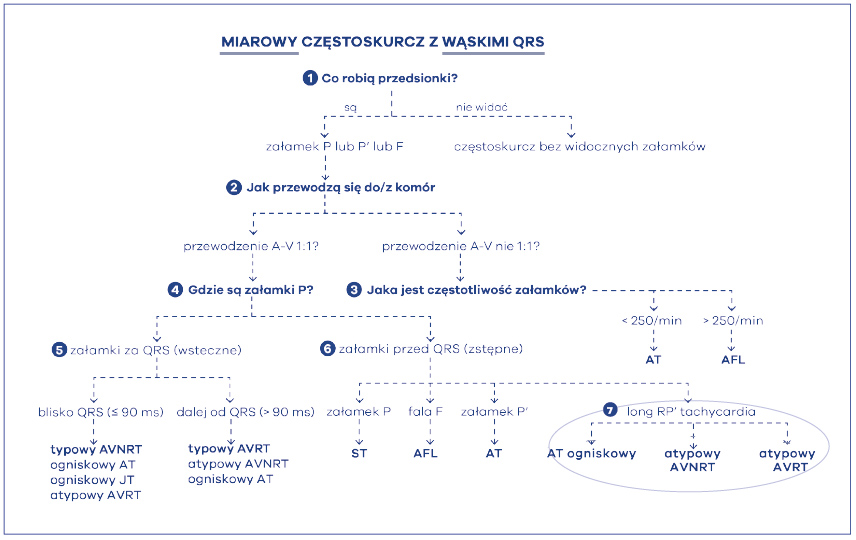
Najważniejszym elementem algorytmu jest znalezienie cech elektrokardiograficznych pracy przedsionków. Należy więc zadać sobie pierwsze pytanie – co robią przedsionki? (ryc. 41) Inaczej mówiąc, szukamy załamków świadczących o czynności przedsionków, czyli P, P’ lub F. Załamek P oznacza, że czynność przedsionków jest pochodzenia zatokowego, zaś P’, że jest pozazatokowa (tzn. przedsionkowe lub węzłowe), natomiast F, że przedsionki są w stanie trzepotania.
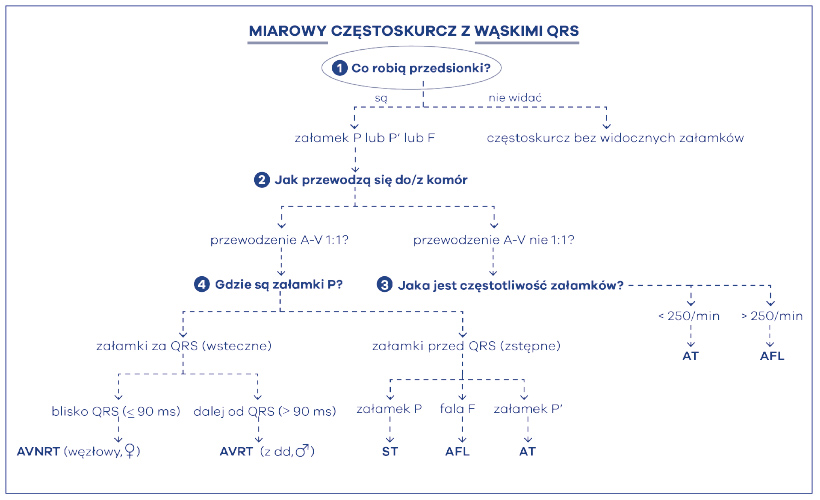
Ryc. 41. Trójstopniowy algorytm Kozłowskiego różnicujący częstoskurcze nadkomorowe (→ krok 1)
W następnym punkcie algorytmu powinniśmy poszukać cech przewodzenia przedsionkowo-komorowego (zstępnego, z góry na dół) lub w pewnych sytuacjach komorowo-przedsionkowego (wstecznego, z dołu do góry) (ryc. 42). Jest to więc drugie pytanie – jak rytm przedsionków przewodzi się do/z komór? Następny punkt algorytmu mówi więc: zobacz, czy masz cechy bloku przedsionkowo-komorowego II stopnia zastępczego albo wstecznego. Pierwszy z wymienionych będzie występował najczęściej. Oczywiście jest to blok czynnościowy, bowiem węzeł p-k nie jest w stanie przepuścić bardzo szybkiego rytmu z góry i blokuje go w tzw. periodyce Wenckebacha. Jest to jego normalna, prawidłowa funkcja. Im szybszy rytm z góry, tym mniej impulsów przewodzi się w dół, do komór, bowiem węzeł p-k nie przepuszcza wszystkiego. Jednakże istnieją częstoskurcze, które mogą przewodzić się do komór bez cech czynnościowego bloku p-k. Dlatego po tym kroku następuje rozwidlenie algorytmu na dwie duże grupy: przewodzenie 1:1 i przewodzenie nie 1:1. W sytuacji przewodzenia p-k w stosunku 2:1 najczęściej mamy do czynienia z szybkim częstoskurczem przedsionkowym (AT – atrial tachycardia) albo trzepotaniem przedsionków (AFL – atrial flutter). Dla częstoskurczu charakterystyczne jest to, że widać rozłączone załamki P’, a pomiędzy nimi jest odcinek linii izoelektrycznej. Ponadto częstość pracy przedsionków w częstoskurczu nie powinna przekraczać 250/min. Dla trzepotania przedsionków, arytmii szybszej, charakterystyczne jest występowanie fali trzepotania, czyli fali F, tzw. „zębów piły”. Pomiędzy falami nie udaje się więc zobaczyć linii izoelektrycznej, a szybkość tej fali jest imponująca – mieści się bowiem w granicach 250-300/min. Najczęściej zresztą jest to 300/min fali F z przewodzeniem przedsionkowo-komorowym 2:1, czyli częstotliwością 150/min zespołów QRS. Aby więc zróżnicować te dwie arytmie należy postawić trzecie pytanie – jaka jest częstotliwość pracy przedsionków? Jeśli ponad 250’ to AFL, jeśli mniej niż 250’ to AT (ryc. 43).
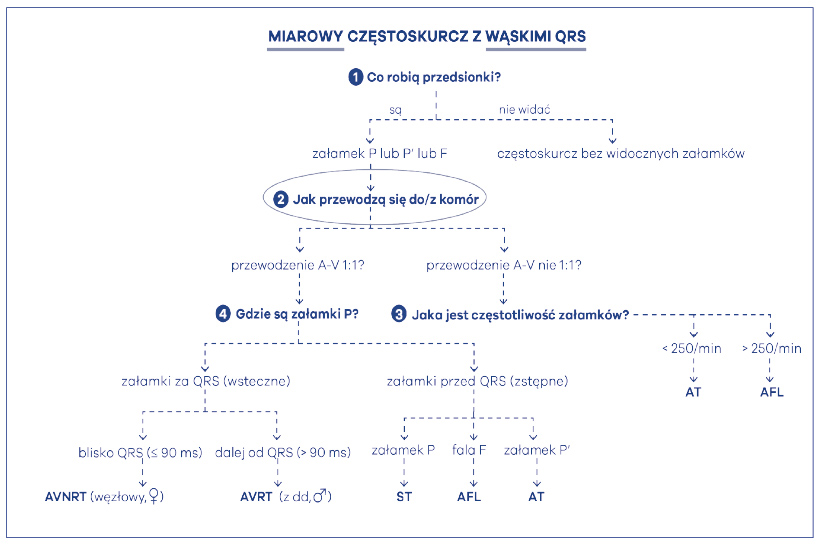
Ryc. 42. Trójstopniowy algorytm Kozłowskiego różnicujący częstoskurcze nadkomorowe (→ krok 2)
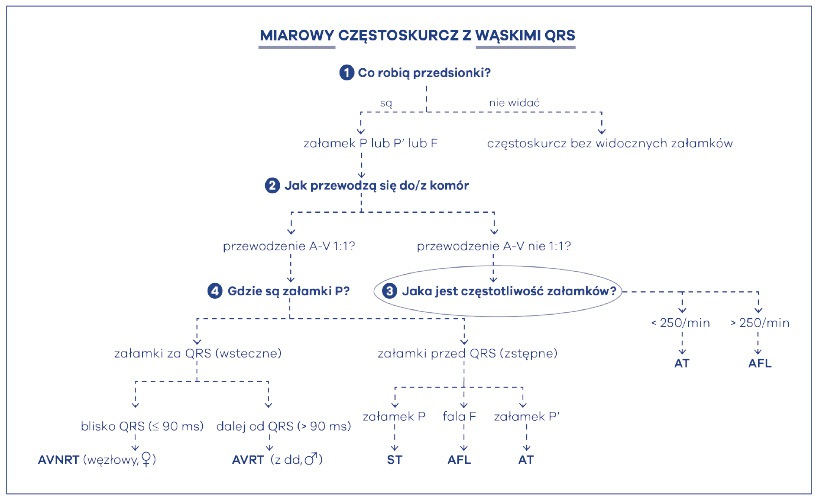
Ryc. 43. Trójstopniowy algorytm Kozłowskiego różnicujący częstoskurcze nadkomorowe (→ krok 3)
W przypadku przewodzenia p-k w stosunku 1:1 najczęściej mamy do czynienia z częstoskurczami ektopowymi (ST, AT) lub nawrotnymi (AVNRT, AVRT). Krocząc więc w lewą stronę algorytmu musimy zadać sobie pytanie: jaki jest stosunek załamków pochodzenia przedsionkowego do zespołów komorowych podczas częstoskurczu? Kolejny krok w naszym algorytmie to sprawdzenie, gdzie znajduje się P’: za zespołem QRS, czy przed zespołem QRS. Proszę zauważyć, że gdy mieliśmy przewodzenie inne niż 1:1, to nie musieliśmy tego robić i nie sprawdzaliśmy, gdzie znajduje się załamek. To proste – jeśli jest np. 2:1, to znaczy, że jeden z załamków jest po prostu za zespołem, zaś drugi przed zespołem komorowym. Gdy jest tylko jeden załamek, musimy to ustalić. W tym celu należy ocenić i porównać odległości PR i RP. Główną zasadą jest pomiar od początku załamka R do początku załamka P. Jeśli PR > RP to znaczy, że załamek jest za QRS‑ em, jeśli zaś PR<RP to jest przed QRS-em. Dodatkowo należy zmierzyć odstęp RP w milisekundach. Obecnie arbitralnie ustalono wielkość tego odstępu na 90 ms (ryc. 44).

Ryc. 44. Trójstopniowy algorytm Kozłowskiego różnicujący częstoskurcze nadkomorowe (→ krok 4)
W tym miejscu warto wyjaśnić co to znaczy, że załamek jest za zespołem komorowym QRS. Tylko to, że przedsionki (załamek P’) są pobudzane po depolaryzacji komór serca. Mamy wówczas do wyboru jedynie dwie arytmie: AVNRT lub AVRT. Proszę zauważyć, że obydwie mają na końcu takie same litery RT. To – z angielskiego – reentry tachycardia. Po polsku, częstoskurcze nawrotne nie znaczy nic więcej, jak tylko częstoskurcze w mechanizmie krążącym (fali nawrotnej). Ale gdzie się kręci taka fala nawrotna podczas częstoskurczu? Wyjaśniają to litery poprzedzające końcówkę RT. Jedna „kręci się” w AVN, czyli węźle przedsionkowo-komorowym, zaś druga w AV, czyli w przedsionkach-komorach. Pierwsza arytmia jest nawrotnym częstoskurczem węzłowym (AVNRT – atrioventricular nodal reentrant tachycardia), zaś druga nawrotnym częstoskurczem przedsionkowo-komorowym (AVRT – atrioventricular reentrant tachycardia) (ryc. 45). Pierwsza kręci się w węźle, zaś druga kręci się między przedsionkami a komorami poprzez drogę dodatkową. Jest to więc arytmia z użyciem drogi dodatkowej – czyli zespół WPW. Na koniec tych rozważań muszę jeszcze raz odwołać się do algorytmu, w którym jest napisane, że dla dokładnego odróżnienia tych arytmii dodatkowo trzeba zrobić jeszcze jeden pomiar: zmierzyć odległość RP’. Proszę zauważyć, że przyjmuje on wartości mniejsze lub równe 90 ms (≤ 90 ms) lub większe niż 90 ms (> 90 ms). Cóż to znaczy? W ten sposób możemy domniemywać jak dużo czasu zabiera w częstoskurczu przejście pobudzenia z komór do przedsionków, czyli z jak wielką pętlą reentry (nawrotną, krążącą) mamy do czynienia. Wiadomo, że nawrotny częstoskurcz węzłowy, kręcący się w malutkim węźle przedsionkowo-komorowym ma małą pętlę arytmii, zaś nawrotny częstoskurcz przedsionkowo-komorowy kręcący się z użyciem drogi dodatkowej (np. położonej na bocznej ścianie serca) ma pętlę dużą. Dlatego im dalej występuje załamek P' za QRS-em, tym pętla częstoskurczu jest większa (zabiera więcej obszaru w sercu) – rozpoznajemy wówczas nawrotny częstoskurcz przedsionkowo-komorowy (AVRT), oczywiście w formie ortodromowej. Mniejsza pętla, to nawrotny częstoskurcz węzłowy (AVNRT). Jeśli przewodzenie przedsionkowo-komorowe wynosi 1:1 a załamki P są przed zespołami QRS, świadczy to o pobudzeniu zstępnym. Wówczas dokładna analiza załamka wystarcza do rozpoznania rodzaju częstoskurczu (ryc. 46). Jeśli załamek P spełnia kryteria zatokowego to częstoskurcz jest zatokowy (ST – sinus tachycardia), jeśli załamek nie spełnia cech zatoki to jest pochodzenia przedsionkowego, a częstoskurcz jest przedsionkowy (AT – atrial tachycardia). Jeśli załamek ma morfologię „zębów piły”, czyli fali F, to rozpoznaje się trzepotanie przedsionków (AFL) przewodzone w stosunku 1:1(!).
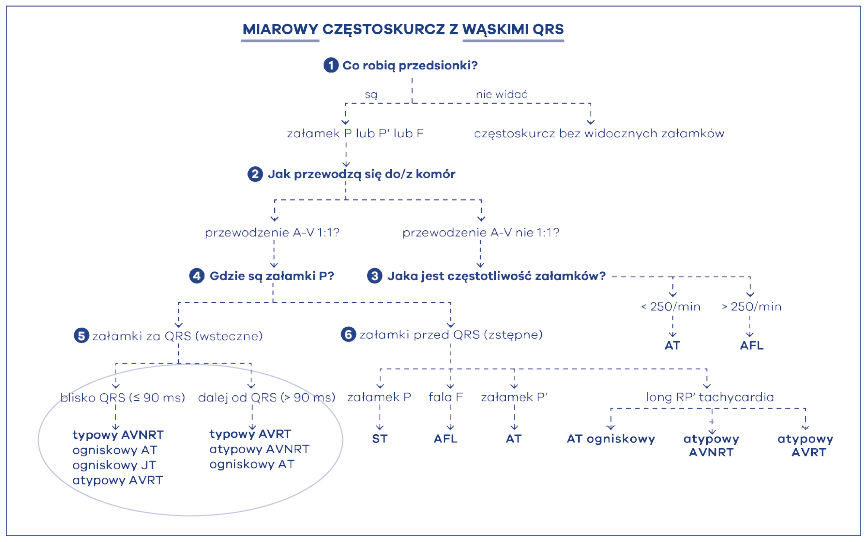
Ryc. 45. Trójstopniowy algorytm Kozłowskiego różnicujący częstoskurcze nadkomorowe (→ krok 5)
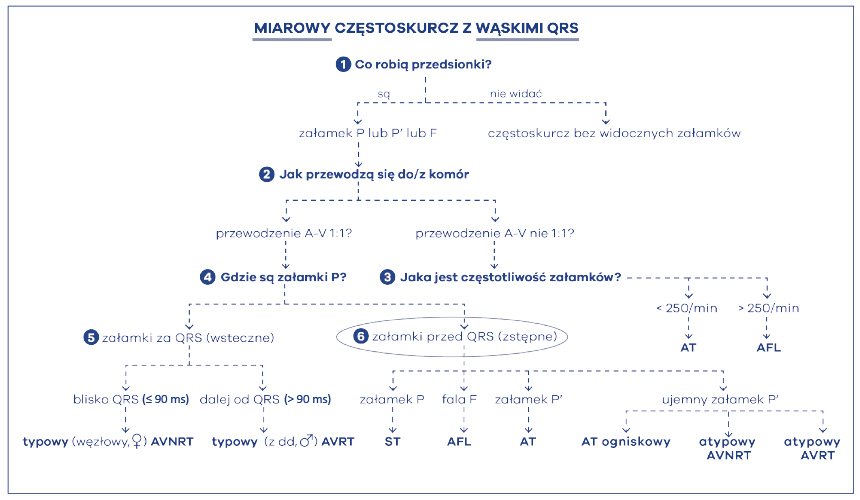
Ryc. 46. Trójstopniowy algorytm Kozłowskiego różnicujący częstoskurcze nadkomorowe (→ krok 6)
W algorytmie bardziej zaawansowanym w przypadku załamków P’ występujących przed zespołami komorowymi QRS można również rozpoznać atypowe formy częstoskurczów (ryc. 47). Zalicza się tu ogniskowy częstoskurcz przedsionkowy z dolnej części przedsionka. Kolejnym jest atypowy częstoskurcz nawrotny węzłowy (tj. w formie fast-slow). Ostatnim jest specyficzny częstoskurcz z użyciem drogi dodatkowej o nietypowych właściwościach. Droga taka przewodzi tylko wstecznie i na dodatek wolno z decrementem (dokładnie tak jak węzeł p-k → ze zwolnieniem przewodzonego impulsu.). Drogę taką odkrył Coumel i dlatego częstoskurcz nosi nazwę częstoskurczu Coumelowskiego (atypowy AVRT).
Ryc. 47. Trójstopniowy algorytm Kozłowskiego różnicujący częstoskurcze nadkomorowe (→ krok 7)
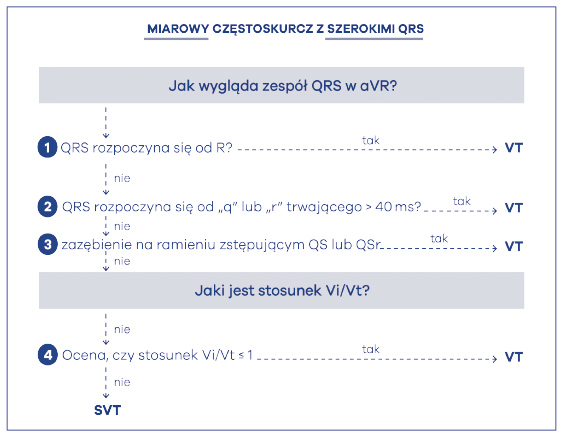
Jednym z najprostszych algorytmów różnicujących częstoskurcze z szerokimi zespołami komorowymi jest algorytm aVR inaczej algorytm na szerokie-miarowe-QRS. Twórcami tego algorytmu są kardiolodzy głównie węgierscy, dlatego nazywa się go, od nazwiska pierwszego autora, algorytmem Vereckei (ryc. 48). Jednym z głównych założeń nowego kryterium, opartego na ocenie odprowadzenia aVR, jest szybkość przewodzenia w komorze. To przekłada się na szybkość narastania pierwszych i końcowych 40 ms zespołu komorowego QRS częstoskurczu z szerokimi zespołami QRS. Jeśli BCT jest spowodowany przez częstoskurcz nadkomorowy (SVT) to początkowa aktywacja przegrody powinna być szybka a zwolnienie przewodzenia w obrębie komór występuje dopiero pod koniec aktywacji. Przekładając to na obraz elektrokardiograficzny należy stwierdzić, że narastanie załamków w zespole QRS w początkowej jego części jest szybkie, a zwalnia się w jego części środkowej albo końcowej. Tak jest w przypadku częstoskurczu SVT, nawet jeśli przewodzi się z okresowym lub stałym blokiem odnogi. Podczas częstoskurczu z szerokimi zespołami QRS, spowodowanego przez częstoskurcz komorowy (VT), mamy sytuację odwrotną. Początkowo wolne rozchodzenie się aktywacji z miocytu na miocyt ma miejsce aż do czasu, w którym impuls osiągnie układ His-Purkinje. Po osiągnięciu tego poziomu depolaryzacji pozostała część mięśnia roboczego komory jest szybciej aktywowana.
Tak więc w częstoskurczach z szerokimi zespołami spowodowanymi VT szybkość przewodzenia początkowej aktywacji komorowej jest wolniejsza niż szybkość przewodzenia końcowej fazy aktywacji. Jest to całkowicie zgodne z mechanizmem częstoskurczu komorowego, niezależnie od tego, czy jest on na tle strukturalnej choroby serca, czy w zdrowym sercu. Wymienieni badacze, w związku z powyższym tokiem myślenia, wprowadzili proste różnicowanie VT z SVT poprzez analizę wyłącznie jednego odprowadzenia. Ustalili więc typowe obrazy dla zespołu QRS w odprowadzeniu aVR dla dwóch rodzajów częstoskurczów: VT (komorowego) lub SVT (nadkomorowego).
Ryc. 48. Czterostopniowy algorytm Vereckei różnicujący częstoskurcze komorowe
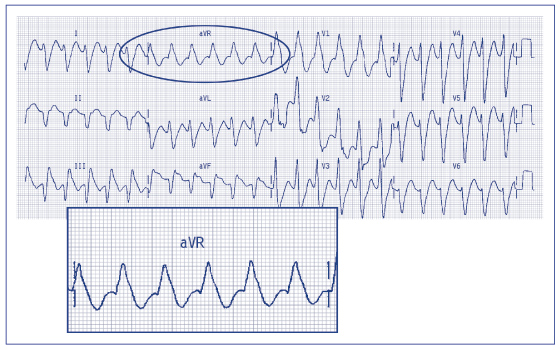
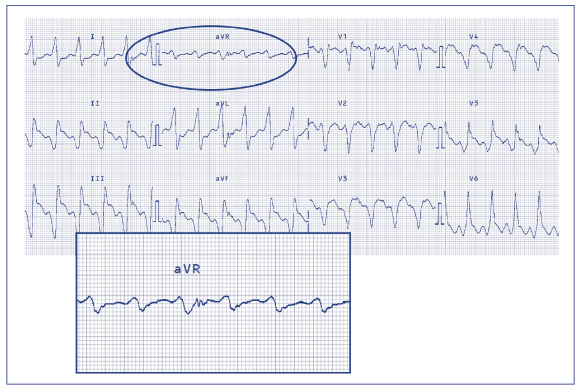
Kryterium morfologii zespołu QRS w aVR (ryc. 48 – jak wygląda QRS w odprowadzeniu aVR – czy w zespole QRS dominuje początkowe R?) nie jest całkowicie nowym kryterium, ponieważ przypomina dawne kryterium osi zespołu QRS (tzw. kryterium osiowe). Kryterium osiowe wskazywało, że oś elektryczna zawierająca się w przedziale -90o ± 180o, czyli w kwadrancie prawym górnym, sugerowała pochodzenie komorowe częstoskurczu. To również wskazywało, że średni wektor QRS powinien zawierać się w przedziale -60o do +120o a to zawsze dawało dominujące pozytywne wychylenie w odprowadzeniu aVR. Dlatego najpierw należy skupić uwagę na poszukiwaniu dominującego załamka R w odprowadzeniu aVR – jest to kluczowe dla rozpoznania częstoskurczu komorowego (VT). Dodatkowo załamek R musi stanowić początek zespołu QRS (tzw. initial R wave). Najlepiej chyba nazwać go po polsku początkowym załamkiem R. Jeśli jest obecny początkowy załamek R w zespole komorowym to rozpoznajemy VT (ryc. 49). Jeśli nie, to należy dalej sprawdzić, czy jest obecny początkowy załamek q lub r o czasie trwania dłuższym niż 40 ms (ryc. 48 – czy w zespole QRS w odprowadzeniu aVR występuje q lub r?). Jeśli tak, to rozpoznajemy VT. I ostatni podpunkt, jeśli te dwa zawiodą – należy sprawdzić, czy występuje zazębienie na zstępującym ramieniu zespołu QS lub QSr w odprowadzeniu aVR. Jeśli jest obecne, to znów rozpoznajemy VT. Podsumowując ten pierwszy krok – jeśli w aVR obecny jest jednofazowy R lub zespół Rs (ok. 40% częstoskurczów komorowych), to rozpoznajemy VT i kończymy różnicowanie (ryc. 50).
Ryc. 49. Czterostopniowy algorytm Vereckei różnicujący częstoskurcze komorowe (→ spełniona cecha – R lub Rs w aVR)
Ryc. 50. Czterostopniowy algorytm Vereckei różnicujący częstoskurcze komorowe (→ spełniona cecha – r lub q > 40 ms)
Kolejnym kryterium, przy niespełnieniu powyższych, jest Vi/Vt w odprowadzeniu aVR (ryc. 48 – jaki jest stosunek Vi/Vt?). Vereckei i wsp. wprowadzili to kryterium jako wyraz szybkości narastania załamków, co ma być równoznaczne z szybkością narastania przewodzenia w komorze. W ten sposób w algorytmie pojawił się odpowiedni pomiar woltażu załamków w QRS-ie w miliwoltach (mV), lub łatwiej w milimetrach (mm). Kryterium Vi/Vt opiera się na ocenie szybkości narastania depolaryzacji w pierwszych 40 milisekundach zespołu QRS w porównaniu do referencyjnych 40 milisekund końcowej części QRS. W częstoskurczach komorowych stosunek początkowej szybkości depolaryzacji do końcowej – Vi/Vt wynosi ≤ 1 (ryc. 51). Parametr ten ocenia się w sposób prosty. Należy najpierw wystawić dwie linie, które będą wyznacznikiem początkowej i końcowej części zespołu QRS. Następnie od tych linii odmierzyć po 40 milisekund do przodu [40 ms początkowe] i od tyłu [40 ms końcowe]. W określonym 40-milisekundowym czasie obserwujemy krzywą ekg i obliczamy przez ile kratek milimetrowych (tak w górę, jak i w dół) krzywa przechodzi w zadanym czasie. Pierwsze 40 ms zespołu QRS określamy jako Vi (ventricle initial part), ostatnie 40 ms zespołu QRS jako Vt (ventricle terminal part) (ryc. 52). Stosunek Vi/Vt > 1 przemawia za częstoskurczem nadkomorowym z blokiem odnogi. Przykładowo, jeśli krzywa przechodziła przez 0,8 mV amplitudy z początku QRS to Vi = 0,8 (lub 8 milimetrowych kratek to Vi = 8). Jeśli końcowe 40 ms zespołu przechodziło przez 0,2 mV kratek to Vt = 0,2 (lub 2 milimetrowe kratki toVi = 2). Wtedy musimy wyliczyć stosunek Vi/Vt = 0,8/0,2 = 8/24, czyli > 1. Taki częstoskurcz określimy jako nadkomorowy, czyli SVT (ryc. 51).
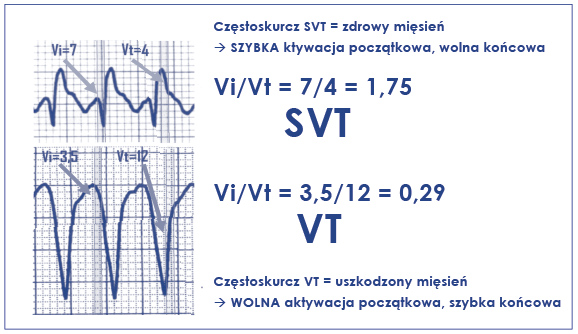
Ryc. 51. Czterostopniowy algorytm Vereckei różnicujący częstoskurcze komorowe (→ spełniona cecha – Vi/Vt ≤ 1)

Ryc. 52. Czterostopniowy algorytm Vereckei różnicujący częstoskurcze komorowe (→ spełniona cecha – Vi/Vt ≤ 1)
Jeszcze prostszy algorytm − tzw. VT score − ułożył prof. Marek Jastrzębski (ryc. 53). Opiera się on na analizie zaspołów komorowych QRS podczas częstoskurczu w odprowadzeniach V1, aVR i II oraz poszukiwanie brugadowskiego braku RS w odprowadzeniach przedsercowych oraz rozkojarzenia komorowo-przedsionkowego. Za każdą spełnioną cechę przydziela 1 pkt, a za rozkojarzenie 2 pkt. Częstoskurcz komorowy VT należy rozpoznać, gdy liczba punktów wynosi ≤ 1 pkt (ryc. 53).
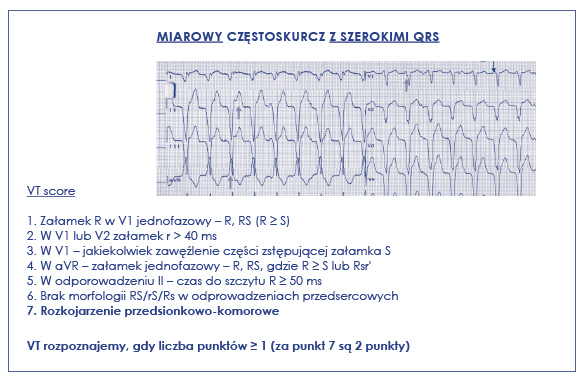
Ryc. 53. Prosty algorytm Jastrzębskiego różnicujący częstoskurcze komorowe
Powyższe algorytmy dotyczyły tachyarytmii miarowych. Jednakże ustalenia wiodącego rytmu wymagają także szybkie rytmy niemiarowe (ryc. 54). Najczęstszą przyczyną niemiarowości są napady migotania przedsionków. Migotanie przedsionków jest najczęstszą arytmią nadkomorową i jej cechą charakterystyczną jest brak załamka P wynikający z braku regularnej czynności elektrycznej/mechanicznej przedsionków. Stwierdza się wówczas niemiarowe, różnokształtne fale migotania (fala f), zwykle najwyraźniej widoczne w V1, V2. Częstotliwość tych fal osiąga poziom > 300 (najczęściej 350/min i więcej), czemu towarzyszy najczęściej niemiarowy rytm odpowiedzi komór (ryc. 55).
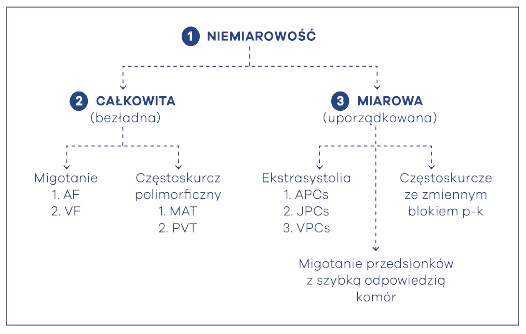
Ryc. 54. Algorytm na częstoskurcze niemiarowe

Ryc. 55. Algorytm niemiarowości niemiarowej (→ nadkomorowe)
Wynika on z czynnościowego, zmiennego bloku przedsionkowo-komorowego. Węzeł nie jest bowiem w stanie przewieźć wszystkich impulsów przedsionkowych przy częstotliwości rytmu powyżej 180-200/min. Nie przewodzi więc wszystkich fal migotania dokomorowo, a jedynie część z nich. Pozostałych naturalnie nie przewodzi, czyli okresowo blokuje – stąd blok czynnościowy. Niemiarowość odpowiedzi komór jest wówczas typowa. Podczas tej arytmii może jednak wystąpić miarowa odpowiedź komór. Miarowość zespołów QRS podczas migotania przedsionków występuje najczęściej w przypadku: 1) obecności innej arytmii niż migotanie, np. trzepotania przedsionków lub 2) cech bloku całkowitego III stopnia z zastępczym rytmem z łącza przedsionkowo-komorowego (wąskie zespoły QRS), lub komór (szerokie QRS). Inną przyczyną miarowości może być występowanie 3) częstoskurczu – przy częstotliwości komór > 60/min – zazwyczaj nienapadowego częstoskurczu z łącza przedsionkowo-komorowego (NPJT) lub > 100/min częstoskurczu komorowego (VT). Inne rozpoznania obejmują miarowość komór podczas 4) stałej stymulacji komorowej – albo w trybie VVI, albo w trybie DDD, które podczas migotania automatycznie przełącza się w tryb VVI (DDD→VVI).
Innym przykładem niemiarowego szybkiego rytmu jest polimorficzny częstoskurcz przedsionkowy (MAT) (ryc. 55). Rozpoznanie polimorficznego częstoskurczu przedsionkowego właściwie nie jest trudne, ale może czasami przysporzyć kłopotów, zwłaszcza jeśli nie zauważy się różnych morfologicznie załamków P’ albo potraktuje się je jako fale migotania f (bezwzględnie należy określić częstotliwość załamków!). Częstoskurcz przedsionkowy polimorficzny przede wszystkim jest niemiarowy i zawiera kilka różnej morfologii załamków P’ (pochodzących z wielu różnych miejsc, ognisk w obydwu przedsionkach) i ma zwyczajowo wąskie zespoły komorowe QRS. Dodatkowo czas odstępów P’R też jest różny, czyli poszczególne pobudzenia przewodzą się z różnym czasem do komór. To bezspornie dowodzi, że częstoskurcz przedsionkowy wychodzi z wielu miejsc. Jest to więc wieloogniskowy częstoskurcz przedsionkowy. Ma on w praktyce lekarskiej wiele nazw: polimorficzny częstoskurcz przedsionkowy, wielokształtny częstoskurcz przedsionkowy, różnokształtny częstoskurcz przedsionkowy, multifokalny częstoskurcz przedsionkowy, chaotyczny częstoskurcz przedsionkowy, czy po prostu MAT (multifocal atrial tachycardia). Kryteria elektrokardiograficzne do jego rozpoznania to: co najmniej trzy różne załamki P’, trzy różne odstępy PR, niemiarowość bezładna. Oczywiście, jeśli nie występuje blok śródkomorowy (odnogi) to zespoły QRS są wąskie. W przypadku występowania bloku lewej czy prawej odnogi zespoły komorowe przyjmują postać bloku – poszerzają się więc do ok. 120 ms (z powodu aberracji 3-fazy).
Niemiarowym częstoskurczem, ale z szerokimi zespołami, jest polimorficzny częstoskurcz komorowy (ryc. 56). Polimorficzne częstoskurcze komorowe są nieregularnymi-niemiarowymi, szybkimi arytmiami, w których szerokie zespoły QRS stale zmieniają swoją morfologię. Najczęściej zmiany te dokonują się w odstępach z uderzenia na uderzenie (beat-to-beat). Arytmia może zaczynać się już od > 100 ud./min. Powszechnie dzieli się tę arytmię na (1) częstoskurcz dwukierunkowy – bidirectional VT, (2) częstoskurcz komorowy typu torsade de pointes (TdP) oraz (3) polimorficzny częstoskurcz komorowy zależny od katecholamin. Częstoskurcz dwukierunkowy – bidirectional VT jest odmianą polimorficznego częstoskurczu komorowego, w którym zespoły komorowe QRS przyjmują morfologię bloku prawej odnogi pęczka Hisa (RBBB) i charakteryzują się naprzemiennością biegunowości w płaszczyźnie czołowej (ryc. 57). Biegunowość ta może oscylować od -60 do +120 stopni. Jest to arytmia komorowa z szerokimi zespołami QRS, które mogą prezentować zazwyczaj 2 morfologie (rzadko więcej), odwracające się pomiędzy sobą. Zespoły komorowe są różne i najczęściej charakteryzują się przeciwnymi wychyleniami. Częstość arytmii obejmuje zakres 140-220 ud./min. Z kolei w polimorficznym częstoskurczu komorowym typu torsade de pointes (TdP) zespoły QRS zmieniają swoją amplitudę i „obracają się” wokół linii izoelektrycznej o 180 stopni przez okres 10-15 uderzeń, po czym powracają do stanu poprzedniego (ryc. 58). W przeciwieństwie do częstoskurczu dwukierunkowego zmiana odbywa się płynnie. Cechą charakterystyczną tego typu częstoskurczu jest „wywracanie się” zespołów QRS do góry nogami (twisting of QRS). Niestety, mimo że jest to patognomoniczna cecha częstoskurczu, występuje ona w rzadkich przypadkach. Schamroth opisując tę arytmię stwierdza, że jeśli w zapisie EKG można rozpoznać wielokształtność, a dodatkowo widać ostro odgraniczone w zespołach QRS szczyty (apices) i dolinki (nadirs), przemawia to za TdP. Ponadto, oś zespołów QRS zmienia się spontanicznie w osi czołowej co kilka sekund, dając obraz „odwracania szczytów” (torsion of points). Niektórzy jednak, celem lepszego różnicowania z częstoskurczem dwukierunkowym, określają zmiany zespołów komorowych mianem „przewijania się” zespołów QRS – szczyty zespołów QRS pojawiają się kolejno po jednej i drugiej stronie linii izoelektrycznej, przechodząc jednak łagodnie, stopniowo. Daje to efekt zwijania i rozwijania się zespołów QRS. W ustalonym TdP zmiany „przewijania” są bardziej ciągłe, a zmiany amplitudy QRS stają się bardziej stopniowe. Dlatego główne kryteria rozpoznania obejmują: zmienną amplitudę i oś zespołów QRS, które powinny być widoczne we wszystkich rejestrowanych odprowadzeniach.
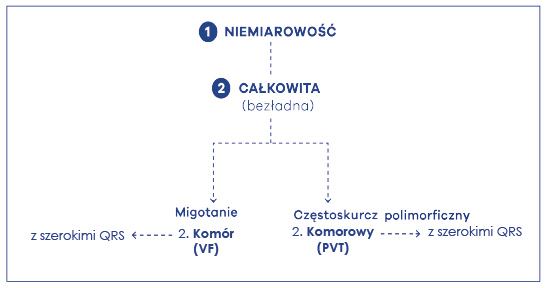
Ryc. 56. Algorytm niemiarowości niemiarowej (→ komorowe)
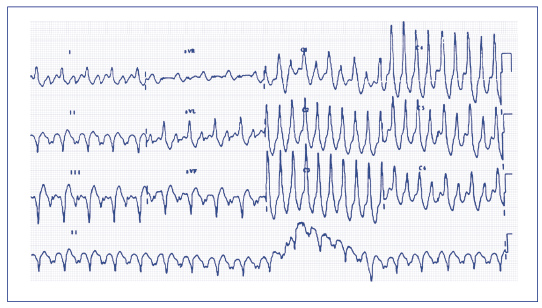
Ryc. 57. Częstoskurcz dwukierunkowy (BiVT)

Ryc. 58. Częstoskurcz torsade de pointes (TdP)
Najczęstszą, zazwyczaj łagodną, niemiarowość miarową (allorytmia rhythmica) powodują pojedyncze ekstrasystolie, czyli przedwczesne skurcze dodatkowe, tak przedsionkowe, jak i komorowe (ryc. 59). Przedwczesne pobudzenia przedsionkowe (APCs) należą do najczęstszych przyczyn niemiarowego tętna. Mogą one wywodzić się z każdego miejsca w przedsionkach, ale także z węzła przedsionkowo-komorowego czy zatokowo-przedsionkowego. Charakteryzują się w EKG wąskimi zespołami QRS i obecnością charakterystycznych załamków przedsionkowych – P’. W przypadku pobudzeń dodatkowych wywodzących się z węzła przedsionkowo-komorowego, załamki P’ wykazują cechy wstecznego pobudzenia przedsionków (ujemne w odprowadzeniach II, III i aVF) lub w ogóle nie występują (zazwyczaj są schowane w obrębie zespołu komorowego QRS). Okresowo wszystkie wymienione powyżej pobudzenia dodatkowe, dające niemiarowość miarową, mogą przewodzić się do komór z opóźnionym przewodzeniem – albo z powodu aberracji 3-fazy, albo stałym blokiem odnogi lewej lub prawej (ryc. 60). Przedwczesne pobudzenia dodatkowe pochodzenia komorowego (VPCs), czyli dodatkowe skurcze pochodzenia komorowego są pojedynczymi dodatkowymi impulsami pochodzącymi z mięśnia komór serca. Najczęściej charakteryzują się one przedwczesnym wystąpieniem szerokiego zespołu QRS, który ma nieprawidłowy, poszerzony w stosunku do normalnego, kształt. Skurcze mogą się odpowiednio układać w stosunku do rytmu podstawowego w bigeminię (VPC wymienia się z prawidłowym pobudzeniem) lub trigeminię (VPC powstaje po 2 pobudzeniach prawidłowych). Po skurczu dodatkowym może dojść do przerwy wyrównawczej lub niewyrównawczej, co jest diametralnie różnie odczuwane przez chorych. Daje to objaw niemiarowości miarowej. Przerwę wyrównawczą chorzy odczuwają jako nagłe zatrzymanie serca, wypadnięcie skurczu, po którym akcja serca wraca do normy. W przypadku przerwy niewyrównawczej w odczuciu chorych rytm jest niezaburzony, a więc nie mają oni poczucia dolegliwości pomimo istniejącego zaburzenia rytmu. Istnieją także pobudzenia wtrącone VPCs, które w zasadzie „podwajają” częstość uderzeń serca – przyspieszając go, zaś VPCs z przerwami wyrównawczymi dają z kolei „podwójne” zwolnienie serca – tzw. zjawisko pseudo-bradykardii.
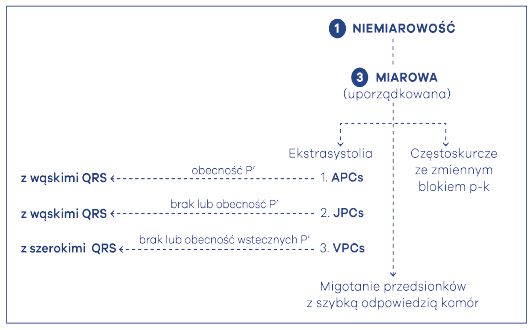
Ryc. 59. Algorytmy niemiarowości miarowej (→ ekstrasystolie + arytmie z blokiem czynnościowym)
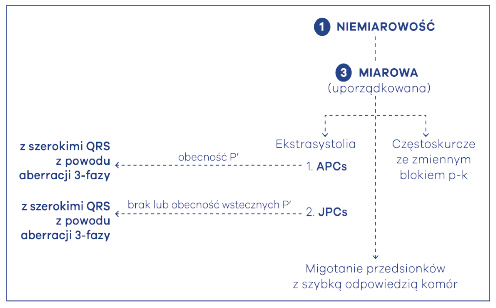
Ryc. 60. Algorytmy niemiarowości miarowej (→ nadkomorowe skurcze dodatkowe)
Krok 7 – Ocena stymulacji defibrylacji serca
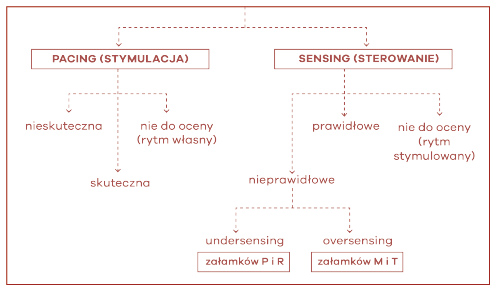
Ostatni krok to ocena prawidłowości działania implantowanego stymulatora serca lub defibrylatora wewnętrznego. Podstawowe zasady obejmują ocenę skuteczności stymulacji oraz prawidłowości sterowania. Najważniejsza jest ocena, czy stymulacja jest skuteczna i jaki typ zaburzeń sterowania występuje w zapisie EKG (ryc. 61).
Ryc. 61. Ocena działania implantowanego stymulatora serca (AAI, VVI, DDD, CRT)
Skuteczną stymulację można rozpoznać po tym, że praktycznie bezpośrednio po „piku” stymulatora (w praktyce opóźnienie kilku lub kilkunastu milisekund jest niemożliwe do zaobserwowania w standardowym EKG) występuje załamek pobudzanej przez rozrusznik jamy serca: załamek P w stymulacji przedsionkowej i załamek R w stymulacji komorowej (ryc. 62). Wyjątek stanowią chorzy ze znacznym uszkodzeniem serca, z przerostem i towarzyszącym zwłóknieniem, u których odstęp ten może ulec wydłużeniu do kilkudziesięciu milisekund, jednak pozostaje on stały dla danego pacjenta.
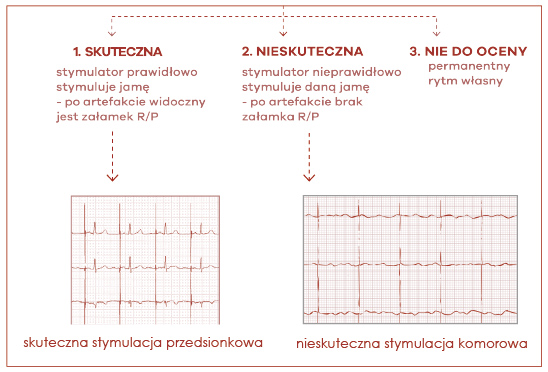
Ryc. 62. Ocena skuteczności stymulacji serca
Zmiana odstępu pomiędzy pikiem stymulatora, a odpowiedzią stymulowanej jamy „z uderzenia na uderzenie” z wysokim prawdopodobieństwem wskazuje na nieskuteczną stymulację. Jako nieskuteczną stymulację np. komorową określa się brak widocznego zespołu QRS w czasie krótszym niż 40 ms od impulsu stymulacji komory. W przypadku jednak stymulacji w układzie bipolarnym mogą być problemy z identyfikacją impulsów stymulacji (podobnie jak w stymulacji przedsionkowej). Ponadto właściwa ocena skuteczności stymulacji może być utrudniona, gdy morfologia wystymulowanych i własnych zespołów QRS jest bardzo podobna. W ocenie skuteczności stymulacji komory może być również pomocna analiza morfologii zespołów QRS – porównanie z własnymi QRS. Powyższa analiza powinna uwzględniać wszystkie dostępne odprowadzenia. Podobnie jak w przypadku stymulacji przedsionkowej brak odpowiedzi na impuls stymulacji komory może być wynikiem występowania impulsu w okresie refrakcji komory, w większości przypadków nie może być opisywany jako nieskuteczna stymulacja komory.
Stymulatory serca, oprócz skuteczności stymulacji, muszą również prawidłowo odbierać i reagować na własne pobudzenia serca. Tę ostatnią funkcję nazywa się sterowaniem, czułością albo z angielskiego sensingiem. Stymulator pod względem sterowania może funkcjonować prawidłowo (sterowanie prawidłowe), albo być za mało czuły na własne impulsy (niedoczułość) lub nazbyt wrażliwy na impulsy elektryczne (nadczułość). Niedoczułość najczęściej dotyczy własnych pobudzeń – fal powstających w miokardium, a więc fali przedsionkowej (fala P) i fali komorowej (fala R). Natomiast w nadczułości biorą najczęściej udział fale elektryczne pochodzące spoza serca, a więc fale mięśni szkieletowych (fala M), ale także fala repolaryzacji (fala T) (ryc. 61).
Ocena implantowanego kardiowertera-defibrylatora (ICD) jest nieco trudniejsza niż stymulatora. Najważniejszym jest ocena skuteczności defibrylacji podczas adekwatnej interwencji (ryc. 63). Jakiekolwiek zaburzenia w tym zakresie należy, ze względów życiowych natychmiast naprawiać. Interwencja adekwatna defibrylatora obejmuje zastosowanie schematu ATP (antitachycardia pacing: burst i ramp), a następnie defibrylacji (shock). Zdarzają się nieadekwatne interwencje ICD. Najczęściej dotyczy to sytuacji klinicznych, podczas których dochodzi do wysokoenergetycznego wyładowania na rozpoznaną arytmię nadkomorową (migotanie przedsionków, trzepotanie przedsionków lub częstoskurcz przedsionkowy). Należy dodać, że taka defibrylacja (ok. 20J) odbywa się z zachowaniem pełnej przytomności chorego, jest więc niezwykle bolesna. Taka sytuacja, mimo iż mniej niebezpieczna, również wymaga natychmiastowej korekty przez kardiologa. Inną przyczyną nieadekwatnej interwencji jest uszkodzenie elementów układu ICD.
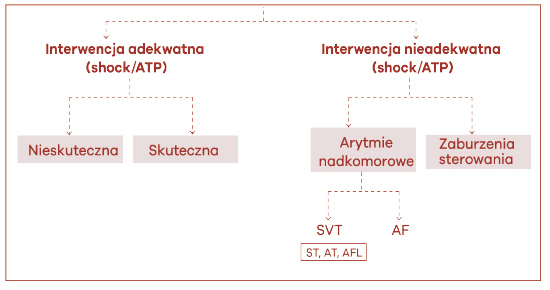
Ryc. 63. Ocena działania implantowanego defibrylatora serca (ICD)
I wreszcie zaburzenia funkcjonowania defibrylatora obejmują zaburzenia sterowania nadczułości (oversensing), mogą obejmować sterowanie załamkiem T, podwójne sterowanie załamkiem R czy odbieranie stymulowanych jam przez inne kanały (ryc. 64).
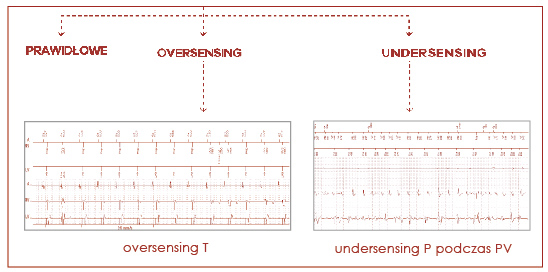
Ryc. 64. Ocena sterowania implantowanego defibrylatora serca
References
| 1. |
Baranowski R, Wojciechowski D, Kozłowski D, Kukla P, Kurpesa M, Lelakowski J, et al. Electrocardiographic criteria fordiagnosis of the heart chamber enlargement, necrosis and repolarisation abnormalities including acute coronary syndromes. Experts’ group statement of the Working Group on Noninvasive Electrocardiology and Telemedicine of Polish-Cardiac Society. Kardiol Pol. 2016;74(8):812–819.
|
| 2. |
Baranowski R, Wojciechowski D, Kozłowski D, Kukla P, Kurpesa M, Lelakowski J, et al. Compendium for performing anddescribing the resting electrocardiogram. Diagnostic criteria describe rhythm, electrical axis of the heart, QRS voltage, automaticity and conduction disorders. Experts’ group statement of the Working Group on Noninvasive Electrocardiology and Telemedicine of Polish Cardiac Society. Kardiol Pol. 2016;74(5):493–500.
|
| 3. |
Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, et al. Fourth universal definition of myocardial infarction(2018). Journal of the American College of Cardiology. 2018; 72(18), 2231-2264.
|
| 4. |
Vereckei A, Duray G, Szénási G, Altemose GT, Miller JM. Application of a new algorithm in the differential diagnosis ofwide QRS complex tachycardia. Eur Heart J. 2007;28(5):589–600.
|
| 5. |
Soar J, Nolan JP, Böttiger BW, Perkins GD, Lott C, Carli P, et al. European resuscitation council guidelines for resuscitation 2015: section 3. Adult advanced life support. Resuscitation, 2015; 95, 100-147.
|